05
8月
研究揭示Dexpramipexole治疗嗜酸性哮喘的显著疗效与安全性
哮喘是一种常见的慢性呼吸系统疾病,全球有超过25亿人受其影响。其中,过半数的患者被归类为嗜酸性哮喘,其病因主要是由于嗜酸性粒细胞的过度产生。为了改善嗜酸性哮喘患者的生活质量,Areteia Therapeutics进行了名为EXHALE-1的II期临床研究,评估其新药Dexpramipexole对嗜酸性哮喘的安全性和疗效。最近,Areteia宣布了该研究的积极拓展结果,并已在《过敏与临床免疫学杂志》(Journal of Allergy and Clinical Immunology, JACI)上在线发表。 EXHALE-1研究概述 该EXHALE-1研究是一项随机、双盲、安慰剂对照的II期... 查看详情
04
8月
市场需求引发糖尿病药物替西帕肽Mounjaro的供应短缺
在医学领域,糖尿病和肥胖一直是全球范围内广泛关注的健康问题。因此,针对这些疾病的治疗药物一直备受关注。礼来公司研发的糖尿病药物Mounjaro(Tirzepatide,替西帕肽)不仅在帮助患者控制血糖方面取得了成功,还在减肥领域显示出了潜力。然而,由于市场需求旺盛,目前该药物供应短缺,这引发了更多对其潜在疗效的追求。 市场对Mounjaro的需求持续旺盛 尽管Mounjaro尚未正式获得减肥用途的批准,但其在减肥领域的潜力引起了市场的高度关注。最近,美国监管机构表示,三种大剂量的Mounjaro在整个7月份出现了“间歇性缺货”,这是由于市场对该药物的需求持续增加所致。而根据美国食品和药物管理局... 查看详情
04
8月
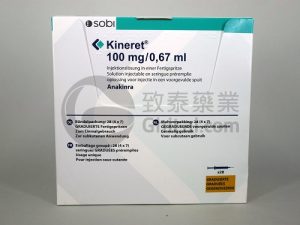
阿那白滞素(Kineret,Anakinra)在不同注射器中的安全性和生物效力比较
在医学领域,针对炎症性疾病的治疗一直是研究的热点。阿那白滞素(Kineret,Anakinra)作为一种重组人白细胞介素-1受体拮抗剂,已获得批准用于此类疾病的治疗。然而,针对该药物在不同类型的注射器中使用的研究相对有限。本文将详细描述我们以前的研究结果,对比了阿那白滞素在硼硅酸玻璃注射器(VCUART3)与聚碳酸酯注射器(VCUART2)以及安慰剂中的应用情况。这些研究针对ST段抬高型心肌梗死(STEMI)患者进行,我们通过比较前14天STEMI期间高敏感性心脏反应蛋白(AUC-CRP)水平曲线下面积,其对心力衰竭(HF)住院、心血管死亡或新诊断的HF的临床效果以及不良事件发生率来评估阿那白... 查看详情
04
8月
索托拉西布sotorasib(Lumakras) 在晚期结肠癌试验中达到目标
近年来,医学领域的科技进步持续不断,对癌症的治疗也在取得令人鼓舞的进展。作为一家生物技术公司,Amgen一直致力于开发创新药物,帮助患者战胜癌症。最近,该公司在结肠癌领域取得了重要突破,其针对KRAS基因的药物索托拉西布sotorasib(Lumakras) 在一项晚期临床试验中获得成功。 试验结果揭示索托拉西布sotorasib(Lumakras) 的潜力 Amgen公司在周四宣布,其针对KRAS基因的药物Lumakras在一项晚期临床试验中取得了成功,延缓了一种特定类型的结肠癌的进展。 据该生物技术公司表示,Lumakras的两种测试剂量都达到了试验的主要目标,即测量所谓的无进展生存期。这... 查看详情
04
8月
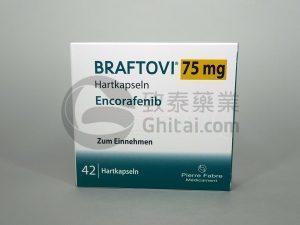
康奈非尼Braftovi+比美替尼Mektovi显著改善晚期BRAFV600突变型黑色素瘤治疗效果
黑色素瘤是一种罕见但高度侵袭性的皮肤癌,严重影响患者的生存质量和预后。过去几年里,通过深入研究相关病理生物学机制,我们成功开发出多种靶向治疗药物,为晚期BRAFV600突变型黑色素瘤患者带来了新的希望。其中,包括康奈非尼(Braftovi,Encorafenib)和比美替尼(Mektovi,Binimetinib)的联合治疗方案(COMBO300)被证实为一种有效的治疗选择。为了更全面地评估该治疗方案的疗效和安全性,美国食品药品监督管理局(FDA)要求进行COLUMBUS试验的第二部分。本文将介绍COLUMBUS试验的第一部分和第二部分的关键研究结果,以及COMBO300相较于康奈非尼Braf... 查看详情
03
8月
FDA批准QN-302用于实体肿瘤临床试验
随着医学科技的不断进步,癌症治疗领域也在不断涌现新的突破和创新。近日,美国食品药品监督管理局(FDA)批准了Qualigen Therapeutics的新药调查申请,允许其进行QN-302用于治疗晚期或转移性实体肿瘤的一期临床试验。这一消息为癌症患者带来了新的希望,也标志着Qualigen Therapeutics迈入了临床阶段的重要里程碑。 QN-302新药调查申请获批 Qualigen Therapeutics近日获得FDA批准,开展QN-302的一期临床试验,旨在治疗晚期或转移性实体肿瘤。该临床试验将在今年下半年启动和招募患者,预计明年完成患者的用药。 QN-302的临床试验设计 这项临... 查看详情
03
8月
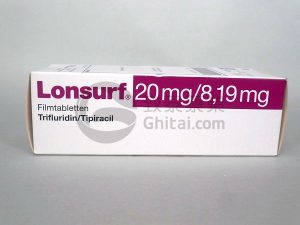
FDA批准曲氟尿苷复方片Lonsurf联合贝伐单抗用于转移性结直肠癌治疗
美国食品药品监督管理局(FDA)已批准Lonsurf曲氟尿苷复方片(Trifluridine/tipiracil)与贝伐单抗(Bevacizumab)联合应用于转移性结直肠癌(mCRC)患者,这些患者之前已接受过氟嘧啶、奥沙利铂、铂酸铁、抗血管内皮生长因子(VEGF)生物治疗以及抗表皮生长因子受体(EGFR)治疗,且肿瘤为RAS野生型。 新适应症的背景 根据FDA发布的新适应症公告,曲氟尿苷复方片Lonsurf在2015年已获得单药用于该适应症的批准。此外,曲氟尿苷复方片Lonsurf也已获得用于治疗转移性胃或胃食管交界腺癌的适应症,前提是该类型患者至少接受过两种治疗方案。 临床试验结果 该组... 查看详情
03
8月
HER2分析预测结直肠癌治疗反应的突破性研究
2023年8月1日,Lunit公司,一家领先的癌症诊断和治疗人工智能解决方案提供商,宣布将在8月3日至8月5日在日本横滨举行的ASCO(美国临床肿瘤学会)突破性会议上展示一项突破性研究。该研究由Lunit和国立癌症中心医院东(NCCHE)的吉野隆之博士共同领导,揭示了通过AI分析HER2(人类表皮生长因子受体2)详细表达谱与转移性结直肠癌(mCRC)患者对帕珠单抗和曲妥珠单抗治疗反应之间关系的重大突破。这项研究展示了Lunit SCOPE HER2的潜力,这是一种AI动力学解决方案,用于检测HER2的详细表达谱,从而为预测mCRC患者的治疗反应提供宝贵的见解,推进个性化医学。 突破性研究:AI... 查看详情
03
8月
突破性迟发性运动障碍检测研究初步入组患者
2023年8月2日,医疗依从技术领军企业iRxReminder, LLC兴奋地宣布其创新项目TDtect™ Diagnostic的首批患者已入组,这一项目由美国国立精神卫生研究所(NIMH)资助。该研究将结合iRxReminder的尖端物联网监测技术以及技术合作伙伴Videra的先进机器学习能力。这一突破性研究的主要目标是验证自动化检测迟发性运动障碍(Tardive Dyskinesia)的可行性,这是与某些心理健康患者用药相关的潜在致命不良反应。 科技的融合:物联网监测技术与机器学习 iRxReminder首席医学官Owen Muir博士表示:“这项研究在提高患者安全性和治疗效果方面迈出了重... 查看详情
02
8月
美国FDA接受心肌病基因疗法LX2020的IND申请
基因疗法作为一种前沿医疗技术,为治疗遗传性疾病带来了新的希望。近日,美国基因疗法开发公司Lexeo Therapeutics喜迎佳音,其心肌病基因疗法候选药LX2020的新药申请已获得美国食品和药物管理局(FDA)的批准。这一重要进展标志着该疗法有望为患有PKP2基因突变引起的心律失常性心肌病的患者带来一次性治疗的希望。 心肌病基因疗法LX2020获得IND批准 位于纽约的Lexeo Therapeutics最近宣布,美国FDA已经批准其心肌病基因疗法候选药LX2020的临床试验新药申请(IND)。LX2020是一种基于腺相关病毒rh10载体的基因疗法,旨在治疗因PKP2基因突变引起的心律失常... 查看详情



-300x225.jpg)