27
8月
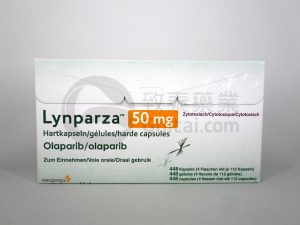
Lynparza(olaparib)组合在日本获批用于某些转移性前列腺癌患者
近日,英国制药公司AstraZeneca宣布,日本监管机构已批准其PARP抑制剂Lynparza(olaparib)与Janssen公司的Zytiga(abiraterone)和prednisone或prednisolone联合应用于BRCA1/2基因突变、去势抵抗性前列腺癌伴有远处转移(mCRPC)患者的治疗。这一决定为日本转移性前列腺癌患者提供了更多的治疗选择。 转移性前列腺癌在日本的现状 前列腺癌是日本癌症死亡的第六大原因,转移性前列腺癌患者的治疗选择有限。该疾病对患者的威胁不可忽视,因此寻找新的治疗方案至关重要。 Lynparza的批准与临床试验结果 日本卫生劳动省在审查了来自III期... 查看详情
26
8月
Soliris在日本获批用于六岁及以上患有难治性全身性重症肌无力(gMG)
英国制药公司AstraZeneca的Soliris(eculizumab)近日获得了日本卫生劳动省(MHLW)的批准,用于治疗六岁及以上患有难治性全身性重症肌无力(gMG)的患者。这是Soliris在日本首次获得批准,也是目前唯一一种针对日本儿童和青少年gMG患者的目标治疗药物。 Soliris成为日本儿童gMG患者的首个批准靶向治疗药物 Soliris的历史和应用范围 Soliris是由Alexion Pharmaceuticals开发的,该公司于2021年被AstraZeneca收购,从而扩大了其罕见病领域的产品线。最近,AstraZeneca还收购了Pfizer的早期罕见病基因治疗组合。... 查看详情
25
8月
FDA批准首款复发性多发性硬化生物仿制药Tyruko(natalizumab-sztn)
在医药领域的持续探索和创新下,突破性的治疗方法不断涌现,为患者带来了新的希望。近日,诺华制药旗下公司山德士(Sandoz)宣布,美国食品药品监督管理局(FDA)已于8月24日批准其生物仿制药Tyruko(natalizumab-sztn),该药是Tysabri(natalizumab)的生物仿制药,用于缓解多发性硬化(MS)复发形式的疾病。 革命性突破:首款治疗复发性多发性硬化生物仿制药 Tyruko的获批意味着这是首个也是唯一一个FDA批准的用于多发性硬化的生物仿制药。Tysabri,作为一种公认的高效抗α4整合素单克隆抗体,以及有效的MS治疗药物,通过这一突破,生物仿制药领域也迎来了崭新的... 查看详情
25
8月
Pegozafermin在非酒精性脂肪性肝炎治疗中的潜力
近年来,非酒精性脂肪性肝炎(NASH)和严重高甘油三酯血症的发病率逐渐增加,迫切需要更有效和安全的治疗手段。Pegozafermin是一种长效的糖基聚乙二醇化(通过特异性糖基转移酶进行聚乙二醇化)成纤维细胞生长因子21(FGF21)类似物,被开发用于治疗NASH和严重高甘油三酯血症。然而,目前Pegozafermin在病理确诊的非肝硬化NASH患者中的疗效和安全性尚未被很好地确立。 研究方法:挑战与方案 在这项为期24周的第2b期多中心、双盲、随机、安慰剂对照试验中,我们随机分配了经组织活检确诊为NASH且处于F2或F3(中度或重度)纤维化阶段的患者,分别接受每周15毫克或30毫克皮下注射Pe... 查看详情
25
8月
多发性骨髓瘤新药Talvey(talquetamab-tgvs)在美国授权的基础上增加了欧洲的批准
近日,杨森制药(Janssen Pharmaceuticals)的双特异性抗体Talvey(talquetamab-tgvs)在美国获得加速批准,作为多发性骨髓瘤成年患者的第五线治疗。如今,这一药物不仅在美国获得授权,还获得了欧洲委员会的批准,成为难治性或复发性多发性骨髓瘤成人患者的第四线治疗。 双特异性抗体Talvey的作用机制 Talvey是一种双特异性抗体,靶向T细胞CD-3受体和G蛋白偶联受体C类5D组成员(GPRC5D)。欧洲药品管理局(EMA)于2021年1月将其列为优先药物(PRIME)。 美国FDA的加速批准及其依据 本月初,Talvey获得了美国食品和药物管理局(FDA)的加... 查看详情
25
8月
FDA批准阻塞性睡眠呼吸暂停治疗新药IHL-42X临床试验计划
近日,美国食品药品监督管理局(FDA)已正式批准Incannex Healthcare公司的新药临床试验申请(IND),允许其启动一项旨在研究IHL-42X治疗阻塞性睡眠呼吸暂停的II/III期临床试验。这一重要的里程碑标志着睡眠医学领域迈出了一大步,为那些因无法耐受或未能遵从正压通气治疗的阻塞性睡眠呼吸暂停患者带来了新的治疗希望。 睡眠呼吸暂停的挑战与机遇 阻塞性睡眠呼吸暂停是一种常见的睡眠障碍,严重影响睡眠质量和患者的生活质量。然而,目前的治疗方法主要集中在正压通气治疗,对于一些患者来说可能并不适用,或者由于各种原因无法坚持使用。 IHL-42X的独特之处 IHL-42X是由人工合成的四氢... 查看详情
24
8月
一种新的靶向治疗方法zolbetuximab为部分胃癌患者带来了希望
胃癌作为全球第五常见的癌症类型,在过去几十年里其发病率显著增加。然而,对于晚期胃癌患者来说,目前的治疗选择相对有限,临床需求迫切。近期,一项国际三期临床试验为这一难题提供了新的解决方案,这项研究由康奈尔医学院(Weill Cornell Medicine)和纽约长老会医院(NewYork-Presbyterian)参与,证实了一种名为zolbetuximab的靶向治疗,结合标准化疗,对于表达特定生物标志物的晚期胃癌或食管胃连接癌患者,能够延长其生存期。 GLOW研究:振奋人心的突破 背景 近日,一项名为GLOW研究的结果在《自然医学》(Nature Medicine)杂志上发表,引起了广泛关注... 查看详情
24
8月
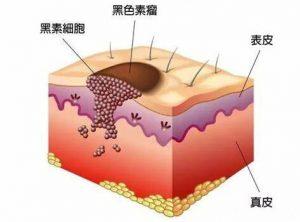
T-VEC可提高可切除黑色素瘤患者的生存率
最新数据显示,肿瘤溶解病毒免疫治疗物质塔利莫基尼拉赫帕病毒(T-VEC;Imlygic)可能会与单纯手术相比,在晚期可切除黑色素瘤患者的5年生存等结果上都显著提升。 研究方法与对象 这项开放式随机临床试验招募了150名患有可切除的IIIB到IVM1a期黑色素瘤,且存在一个或多个可注射的皮肤、皮下或淋巴结病变的患者。 患者被随机分配到接受前切割期T-VEC注射(第一组)后进行手术,或者仅进行即刻手术(第二组)。研究人员可以自行选择提供什么类型的辅助疗法。 T-VEC是一种逐周注射的局部疫苗,在1、4、6、8、10和12周的第一天进行,直至手术结束、没有剩余的可注射肿瘤或者出现不耐受。 研究的主要... 查看详情
24
8月
FDA批准首个用于孕期的呼吸道合胞病毒(RSV)疫苗Abrysvo
周一,备受期待的孕期呼吸道合胞病毒(RSV)疫苗终于获得了美国食品药品监督管理局(FDA)的批准。这款名为“阿布利斯沃(Abrysvo)”的疫苗可在孕32至36周之间接种,旨在保护婴儿从出生到6个月的时期免受RSV病毒的侵害。 孕期保护婴儿:历史性突破 阿布利斯沃是一款单剂量肌肉注射疫苗,于5月底获得FDA批准,用于预防60岁及以上人群中由RSV引起的下呼吸道疾病。然而,正如FDA生物制品评价与研究中心主任Peter Marks博士所指出的:“RSV是儿童疾病的常见原因,婴儿是严重疾病风险最高的人群之一,严重病例可能导致住院。”他在一份新闻稿中表示:“这次批准为医疗保健提供者和孕期个体提供了一... 查看详情
24
8月
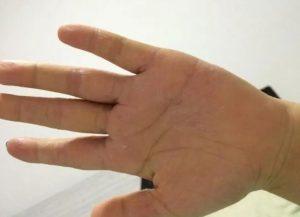
EMA批准Delgocitinib乳膏上市许可申请
近日,欧洲药品管理局(EMA)正式认可了Delgocitinib乳膏的上市授权申请,该乳膏旨在治疗慢性中重度手部湿疹患者。这一认可标志着欧洲药品管理局人用药品委员会(Committee for Medicinal Products for Human Use)开始对该治疗方案展开审查。 背景与治疗创新 Delgocitinib是一种正在研究中的局部泛白介素-丙种激酶抑制剂,能够有效抑制JAK-STAT通路的激活。手部湿疹作为一种常见的皮肤疾病,对患者的生活质量造成了极大的影响,因此迫切需要一种新的、有效的治疗方法。 临床试验取得的突破 本次药物开发的背后是两项3期临床试验,分别命名为DELTA... 查看详情