21
9月
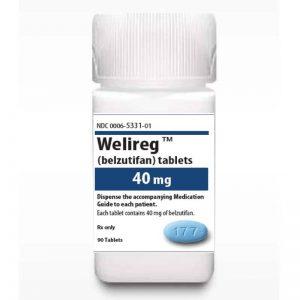
FDA将优先审查肾细胞癌靶向疗法Welireg(belzutifan)的补充新药
肾细胞癌(RCC)作为肾癌的最常见形式,一直是医学界和患者面临的重大挑战之一。肾细胞癌通常在不经意的情况下被发现,对患者的生活质量和生存构成了威胁。然而,令人振奋的消息是,药物Welireg(belzutifan)可能为晚期肾细胞癌患者带来新的希望。美国食品药品监督管理局(FDA)已同意对Welireg(belzutifan)的补充新药申请进行优先审查,这标志着一项潜在的肾细胞癌靶向疗法即将问世。 肾细胞癌的严峻挑战 肾细胞癌是肾癌中的主要类型,约占肾癌病例的九成。这一癌症在男性中的发病率是女性的两倍,使其成为男性罹患的高发癌症之一。令人不安的是,大多数肾细胞癌病例都是在进行其他腹部疾病的影像... 查看详情
20
9月
Tislelizumab(Tevimbra)在欧洲获批用于铂类化疗后的晚期食管鳞癌
食管鳞癌(ESCC)是一种恶性肿瘤,常常在诊断时已经进展到晚期,对治疗造成了巨大挑战。然而,一项新的生物制剂已获得欧洲委员会批准,为晚期ESCC患者带来了新的希望。该生物制剂名为Tislelizumab(Tevimbra),它被批准用于接受过铂类化疗的成年患者,这些患者患有不可切除的、局部晚期或转移性食管鳞癌。 改善患者生存期 Tislelizumab的批准基于RATIONALE 302试验的数据,该试验表明,在意图治疗(ITT)人群中,接受Tislelizumab治疗的患者在总生存期(OS)方面表现出明显的统计学和临床意义上的改善,与接受医生选择的化疗治疗的患者相比(HR,0.70;95% ... 查看详情
20
9月
Tislelizumab(Tevimbra)一线治疗食管鳞癌申请FDA批准
食管鳞癌(食道鳞状细胞癌,ESCC)是一种具有挑战性的癌症类型,通常在晚期才被发现,难以治疗。然而,一项新的生物制药申请已提交FDA审批,旨在改善这一情况。该申请寻求批准使用Tislelizumab(Tevimbra)作为一线治疗,用于治疗不可切除、复发、局部晚期或转移性食管鳞癌患者。 一项潜在的重要突破 Tislelizumab是一种PD-1抗体,已在某些其他类型的癌症治疗中取得了显著的突破。现在,它有望成为食管鳞癌治疗的一部分。 这一申请得到了来自RATIONALE 306(NCT03783442)研究的支持,该研究发现,将Tislelizumab与化疗联合使用可以改善患者的总生存期(OS... 查看详情
20
9月
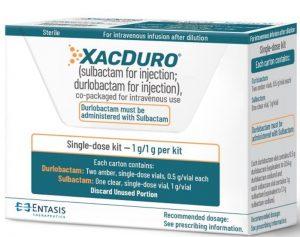
不动杆菌终有克星!Xacduro(舒巴坦,杜洛巴坦)打破不动杆菌耐药性的抗生素突破
抗生素是现代医学中不可或缺的工具,但随着时间的推移,细菌的耐药性逐渐崭露头角,成为医学界面临的一大挑战。在这个背景下,针对一种致命细菌——不动杆菌(也称为鲍氏不动杆菌)的耐药性感染,常常让医生束手无策。然而,一项重要的突破已经出现在医学领域:Xacduro(注射用舒巴坦;注射用杜洛巴坦),这是首个专门针对不动杆菌的抗生素,已获得美国FDA批准,用于治疗医院获得性细菌性肺炎(HABP)和呼吸机相关性细菌性肺炎(VABP)的成年患者。 不动杆菌的威胁 不动杆菌是一种革兰氏阴性菌,通常在医疗机构中引起感染,其中以肺炎最为常见。然而,不动杆菌感染如今已经成为全球第五大由耐药性引起的最常见死因,对于使用... 查看详情
20
9月
FDA批准Talicia治疗幽门螺杆菌感染的新给药方案
幽门螺杆菌感染是一种全球广泛存在的健康问题,危害人类健康。幸运的是,生物制药公司RedHill取得了重大突破,通过其药物Talicia的补充新药申请(sNDA)获得了美国食品药品监督管理局(FDA)的批准,这一药物采用更为灵活的给药方案,用于治疗成人幽门螺杆菌感染。 更灵活的给药方案:让治疗更便捷 传统上,FDA批准的治疗幽门螺杆菌感染的给药方案要求患者每8小时服用一次药物,这对于许多患者来说可能是个挑战。然而,现在,FDA已经批准了更灵活的给药方案,允许患者每日三次服用Talicia,每次至少间隔4小时,并可以与食物一起服用,这意味着患者可以轻松地将药物安排在早餐、午餐和晚餐时段,这一改进有... 查看详情
19
9月
EMA授予Iopofosine I-131治疗Waldenström巨球蛋白血症的PRIME认证
在白血病和淋巴瘤等血液系统疾病领域,科学家和医生们不断寻求创新的治疗方法,以提高患者的生存率和生活质量。近期,一种名为Iopofosine I-131的药物获得了欧洲药品管理局(EMA)的Priority Medicines(PRIME)认证,用于治疗已接受至少两种治疗方案的Waldenström巨球蛋白血症患者。 Iopofosine I-131的PRIME认证 药物简介 Iopofosine I-131(之前称为CLR 131)是一种小分子磷脂药物结合物,目前正在研究中,用于治疗选择性B细胞恶性肿瘤,作为CLOVER-1试验的一部分。这一药物已经获得EMA的PRIME认证,用于治疗已接受至... 查看详情
19
9月
FDA授予KT-333用于R/R CTCL和PTCL的快速通道地位
淋巴瘤是一种严重的血液系统疾病,常常需要创新的治疗方法来帮助那些反复发作或难以治愈的患者。在这个领域,一种名为KT-333的全新药物正在取得突破性进展,已经获得了美国食品和药物管理局(FDA)的快速通道地位,用于治疗反复发作或难治性的皮肤T细胞淋巴瘤(CTCL)和外周T细胞淋巴瘤(PTCL)患者。 KT-333:瞄准STAT3的新一代药物 药物简介 KT-333是一种全新的药物,具有高度选择性,专门用于降解STAT3蛋白。STAT3蛋白在促进与肿瘤细胞的生存、增殖、干细胞特性和转移有关的基因表达方面起着关键作用。此外,STAT3还促进了肿瘤微环境中免疫抑制细胞的分化和活性。 快速通道地位的意义... 查看详情
19
9月
欧洲推荐批准ADCETRIS(Brentuximab Vedotin)联合AVD治疗霍奇金淋巴瘤
霍奇金淋巴瘤是一种少见但严重的淋巴系统疾病,对患者的生活造成了巨大的影响。近年来,随着医学研究的不断进步,新的治疗方法和药物不断涌现,为患者带来了新的希望。最近,欧洲药品管理局的人用药品委员会(CHMP)发布了一项重要的正面意见,推荐批准ADCETRIS(Brentuximab Vedotin)与Doxorubicin、Vinblastine和Dacarbazine(AVD; A+AVD)联合使用,用于治疗先前未接受治疗的CD30阳性三期霍奇金淋巴瘤成年患者。 ADCETRIS(Brentuximab Vedotin):精准治疗霍奇金淋巴瘤的利器 药物简介 ADCETRIS(Brentuxim... 查看详情
19
9月
欧洲推荐批准曲妥珠单抗生物类似药物EG12014治疗HER2阳性乳腺癌和胃癌
欧洲药品管理局(EMA)的人用药品委员会(CHMP)已发表了一份正面意见,推荐批准EirGenix的Trastuzumab(Herceptin)生物类似药物EG12014,用于治疗HER2阳性乳腺癌和转移性胃癌患者。 乳腺癌和胃癌是欧洲最常见的癌症之一,每年共导致近20万人死亡。Biosimilars有望通过大幅增加这些关键药物的获得,从而显著改善癌症治疗。 EG12014生物类似药物:针对HER2阳性癌症的新选择 生物类似药物介绍 EG12014是一种生物类似药物,旨在治疗HER2阳性乳腺癌和转移性胃癌。它以与参考生物类似药物相同的途径通过静脉注射150毫克剂量进行给药。这一药物的适应症范围... 查看详情
18
9月
Tovorafenib已完成FDA关于复发或进展性儿童低级别胶质瘤的滚动NDA提交
儿童低级别胶质瘤(pLGG)是一种罕见但严重的儿童神经系统肿瘤,占所有中枢神经系统肿瘤的30%至50%。 对于患有pLGG的患儿,癫痫和治疗相关的并发症可能对他们的长期生活轨迹产生深远影响。 然而,目前对于大多数复发或进展的pLGG患者,尚无标准治疗方案,也没有获得批准的药物。 近日,Day One Biopharmaceuticals宣布已提交关于单药tovorafenib(Ojemda)用于复发或进展的儿童低级别胶质瘤(pLGG)的滚动新药申请(NDA)给美国食品和药物管理局(FDA)。 如果一切顺利,预计FDA将于2023年11月中旬提交滚动NDA。 pLGG的挑战 pLGG是儿童中最常... 查看详情