30
10月
FDA批准ONCT-534用于治疗转移性去势难治前列腺癌
2023年10月26日,Oncternal Therapeutics宣布,美国食品和药物管理局(FDA)已将其创新药物ONCT-534列为快速通道开发项目,用于治疗去势难治前列腺癌(mCRPC)患者,这些患者对已批准的雄激素受体途径抑制剂(ARPIs)无效。这一消息标志着一项重大的突破,为前列腺癌患者带来了新的希望。本文将详细介绍ONCT-534的FDA批准以及相关研究。 ONCT-534的快速通道批准 ONCT-534是Oncternal Therapeutics研发的一种新型双重作用雄激素受体抑制剂(DAARI),针对那些对已批准的ARPIs治疗无效的复发或难治mCRPC患者。这一批准将大... 查看详情
30
10月
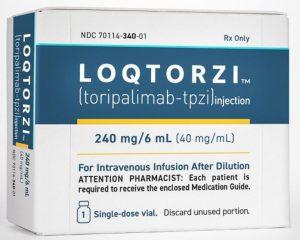
FDA批准LOQTORZI(特瑞普利单抗)用于鼻咽癌治疗
2023年10月27日,君实生物与合作伙伴Coherus BioSciences共同宣布,美国食品和药物管理局(FDA)已批准LOQTORZI™(toripalimab-tpzi),即特瑞普利单抗的美国适应症,用于治疗鼻咽癌(NPC)。这一重大突破代表着一项全新的免疫疗法,将为鼻咽癌患者带来更多治疗选择。 LOQTORZI™的适应症扩展 新的批准使LOQTORZI™的适应症扩展至以下两个方面: 作为一线治疗,特瑞普利单抗与吉西他滨/顺铂联合使用,用于治疗晚期复发或转移性鼻咽癌(R/M NPC)患者。 作为二线及以上治疗的单药治疗,用于复发或转移性鼻咽癌,这些患者已接受含铂化疗的治疗。 这一批准... 查看详情
30
10月
澳门批准Nefecon(布地奈德迟释胶囊)治疗成人IgA肾病
2023年10月27日,云顶新耀(Everest Medicines)正式宣布,在中国澳门特别行政区药物管理局的批准下,Nefecon®(布地奈德迟释胶囊)将成为治疗IgA肾病的一项突破性疗法。这一消息为那些患有IgA肾病并且面临疾病进展风险的成年患者带来了新的曙光。Nefecon®的批准意味着患者将获得一种创新的治疗方法,可以显著改善他们的生活质量并减少疾病进展的风险。 Nefecon®的临床试验和疗效 Nefecon®的批准是基于NefIgArd 3期临床试验的积极结果而来的。这是一项随机、双盲、多中心研究,针对接受优化RASi治疗的原发性IgA肾病成年患者进行的。试验评估了每日一次16m... 查看详情
29
10月
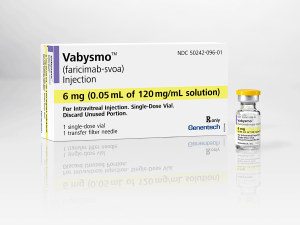
FDA批准Vabysmo(Faricimab)治疗视网膜静脉阻塞继发黄斑水肿
2023年10月27日,罗氏(Roche)正式宣布,他们的最新眼科双抗药物Vabysmo(法瑞西单抗)获得了美国食品和药物管理局(FDA)的批准,用于治疗视网膜静脉阻塞(RVO)继发黄斑水肿。这一消息为数百万患有RVO的患者带来了新的曙光,标志着医学领域又一次的巨大突破。 I. Vabysmo的背后故事 Vabysmo(法瑞西单抗)的成功故事源自罗氏的不懈努力,该药物是一种靶向血管生成素2(Ang2)和血管内皮生长因子A(VEGFA)的双特异性单克隆抗体。自2022年1月首次在美国获批上市以来,它已在治疗糖尿病黄斑水肿(DME)和湿性年龄相关性黄斑变性(wAMD)方面展现出杰出的成绩。现在,它... 查看详情
28
10月
Pemvidutide治疗非酒精性脂肪性肝炎获FDA快速通道资格
非酒精性脂肪性肝炎(NASH)是一种肝脏疾病,其严重形式可能导致肝硬化和心血管疾病,却一直没有获得批准的治疗方法。然而,新药Pemvidutide的快速通道资格获得FDA批准,为NASH患者带来了新的希望。本文将深入探讨Pemvidutide的药理作用、临床试验结果以及潜在治疗前景。 非酒精性脂肪性肝炎(NASH)是非酒精性脂肪性肝病(NAFLD)的严重形式,其特点是肝脏脂肪堆积,可能导致炎症、纤维化,最终引发肝硬化和增加心血管疾病风险。然而,截至目前,NASH的治疗选择非常有限,患者急需一种创新疗法。 药理机制:Pemvidutide的独特之处 Altimmune公司在2023年10月26日... 查看详情
27
10月
FDA批准Omvoh(mirikizumab-mrkz)治疗中度至重度活动性溃疡性结肠炎
美国食品药品监督管理局(FDA)最近批准了Eli Lilly and Company(纽约证券交易所:LLY)的Omvoh™(mirikizumab-mrkz)静滴注射剂/注射液(300毫克/15毫升),这是成人中度至重度活动性溃疡性结肠炎(UC)的第一个也是唯一的白细胞介素23p19(IL-23p19)拮抗剂。 Omvoh标志着一个重要的里程碑,它是唯一有选择性地靶向IL-23的p19亚单位的UC治疗方法,该亚单位在与UC相关的炎症中发挥作用。 根据Icahn School of Medicine at Mount Sinai的布鲁斯·桑兹医学博士的说法:“我接触了许多患有溃疡性结肠炎的患者... 查看详情
27
10月
进展性肺纤维化疗法BMS-986278取得FDA突破性认定
2023年10月24日,Bristol Myers Squibb(NYSE:BMY)宣布美国食品和药物管理局(FDA)已为BMS-986278授予突破性疗法认定,这是一种潜在的首创性口服药物,为进展性肺纤维化(PPF)的治疗提供新途径。进展性肺纤维化是一种具有毁灭性和威胁生命的疾病,目前只有一种治疗方法被批准用于其治疗。本文将深入探讨这一好消息,分析BMS-986278的突破性潜力以及它对肺纤维化患者的重大影响。 突破性认定:新希望 获得FDA的突破性疗法认定是基于全球范围内进行的随机分组的2期研究结果,该研究评估了BMS-986278治疗与安慰剂在特发性肺纤维化(IPF)和PPF患者中的安全... 查看详情
27
10月
FDA批准Agamree(vamorolone)治疗杜氏肌营养不良症
2023年10月26日,美国食品和药物管理局(FDA)批准了Agamree(vamorolone)口服悬浮液40毫克/毫升,用于治疗杜氏肌营养不良症(DMD)患者,年龄为两岁及以上。这一突破性的决定将改变DMD治疗的格局,填补了重大的医疗需求空白。 Agamree:解决DMD医疗需求的新选择 Agamree(vamorolone)的获批标志着杜氏肌营养不良症患者的新希望。这一药物的独特之处在于它是一种新型糖皮质激素治疗选择,以弥补现有治疗方法的不足。在2023年7月,Catalyst Pharmaceuticals, Inc.(Catalyst公司)获得了Agamree在北美地区的独家许可和商... 查看详情
26
10月
BMS-986278被FDA授予进行性肺纤维化治疗的突破性称号
肺纤维化是一种严重的间质性肺病,威胁着患者的生命。该疾病导致肺组织受损和结疤,严重影响肺功能。特发性肺纤维化(IPF)是其最常见的形式,而进行性肺纤维化(PPF)则描述了那些表现出进行性纤维化的ILD患者。幸运的是,最近的一项突破性治疗认证已经为一种新的药物BMS-986278颁发,它在治疗PPF患者方面具有巨大的潜力。 肺纤维化:一个威胁生命的挑战 肺纤维化是一种进展性肺病,它损害肺部的结构和功能。该疾病的最常见类型是特发性肺纤维化,它以进行性纤维化和肺功能下降为特征。患者经历呼吸困难、疲劳和生活质量下降,这使得寻找有效的治疗方法至关重要。 BMS-986278:突破性治疗的希望 在肺纤维化... 查看详情
25
10月
Etripamil用于治疗阵发性室上性心动过速向美国FDA提交新药申请
2023年10月24日,Milestone Pharmaceuticals公司(纳斯达克代码:MIST)宣布向美国食品和药物管理局(FDA)提交了一份新药申请(NDA),申请其新药Etripamil的批准,用于治疗阵发性室上性心动过速(PSVT)。PSVT是一种心脏电气系统异常引发的心跳不齐,患者常常会出现突如其来的、严重症状的快速心率发作。 该公司相信,代表着PSVT领域最大的数据资料包括来自关键的第三阶段RAPID临床试验的积极结果,证明了Etripamil相较于安慰剂在恢复PSVT患者的正常心脏节律方面,具有两倍的疗效和三倍的速度。 Etripamil的有条件批准品牌名为CARDAMYS... 查看详情