22
2月
FDA授予Ocifisertib治疗急性髓系白血病的孤儿药认定
白血病作为一种严重的血液疾病,一直以来都是医学界的重点研究对象。针对急性髓系白血病(AML)患者的治疗一直是临床医学面临的巨大挑战之一。近日,美国FDA授予了ocifisertib治疗AML的孤儿药品认定,这一举措为AML患者带来了新的治疗希望。 Ocifisertib的孤儿药品认定 根据Treadwell Therapeutics的公告,美国FDA授予了ocifisertib(CFI-400945 fumarate)治疗AML的孤儿药品认定。这一认定为AML患者提供了潜在的治疗选择。此次认定是针对ocifisertib在治疗复发或难治性AML或骨髓增生异常综合征(MDS)患者的安全性和耐受性... 查看详情
22
2月
Vyvgart Hytrulo治疗慢性炎性脱髓鞘性多发性神经病的sBLA获FDA优先审查
近年来,生物制品的研发与应用在医学领域取得了巨大突破,为治疗各种疾病提供了新的选择。在这个背景下,全球免疫学公司argenx SE的Vyvgart Hytrulo(efgartigimod alfa和透明质酸酶-qvfc)的研发备受瞩目。针对慢性炎症性脱髓鞘性多发性神经病(CIDP)的补充生物制品许可申请(sBLA),更是吸引了美国FDA的优先审查。 Vyvgart Hytrulo的研发与应用 Vyvgart Hytrulo是一种皮下组合物,包含efgartigimod alfa和重组人透明质酸酶PH20。其中,efgartigimod alfa是一种人IgG1抗体片段,而重组人透明质酸酶PH... 查看详情
21
2月
英国NICE批准皮下Tepkinly(Epcoritamab)治疗复发或难治性弥漫性大B细胞淋巴瘤
在医学领域,特别是癌症治疗方面,新药的研发和批准对于患者来说意味着新的希望和机会。最近,AbbVie公司的一项新药Tepkinly在治疗复发性或难治性治疗复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)方面获得了英国国家健康与护理卓越研究所(NICE)的认可,为DLBCL患者带来了一线生机。 NICE对于Tepkinly的认可 英国国家卫生与护理卓越院(NICE)已经推荐AbbVie的Tepkinly(epcoritamab)作为第三线治疗选择,用于治疗复发性或难治性弥漫性大B细胞淋巴瘤(DLBCL)成年患者。这一认可意味着,Tepkinly成为了一种新的治疗选择,为那些已经经历过至少两种前期治... 查看详情
21
2月
Sibeprenlimab治疗免疫球蛋白A肾病获美国FDA突破性疗法认定
慢性肾脏疾病是全球范围内健康领域的一个重要挑战,其中免疫球蛋白A肾病(IgAN,也称Berger氏病)是最常见的原发性肾小球肾炎类型之一,常常导致肾衰竭。然而,目前对IgAN的治疗仍然存在挑战,因此寻找更有效的治疗方案迫在眉睫。近日,一项具有突破性意义的消息传来:美国食品药品监督管理局(FDA)授予了sibeprenlimab治疗IgAN的突破性疗法认定,这为该疾病的治疗带来了新的曙光。 突破性治疗认定:sibeprenlimab在IgAN治疗中的潜力 sibeprenlimab是一种人源化的单克隆抗体,它通过阻断B细胞生长因子APRIL(a proliferation-inducing li... 查看详情
21
2月
FDA批准帕博利珠单抗联合化疗治疗子宫内膜癌的优先审评
近年来,免疫疗法在癌症治疗中的地位日益凸显,其在改善患者预后和生活质量方面展现出了巨大的潜力。在这个背景下,美国食品药品监督管理局(FDA)对于新药物的批准显得尤为重要。最近,FDA对于在子宫内膜癌治疗中使用帕博利珠单抗(Keytruda,Pembrolizumab)联合化疗的申请进行了优先审查,这无疑为这一患者群体的治疗带来了新的曙光。 关键信息概述 申请了帕博利珠单抗(Keytruda,Pembrolizumab)联合标准治疗化疗的补充生物制剂许可证申请(sBLA)已被FDA授予优先审查。该申请的截止日期被定为2024年6月21日。 临床试验结果与意义 NRG-GY018是一项双盲、安慰剂... 查看详情
21
2月
FDA优先审查Krazati(Adagrasib)/Erbitux联合治疗KRAS G12C突变型结直肠癌
结直肠癌是一种常见的恶性肿瘤,对于KRAS G12C突变型结直肠癌患者的治疗一直是个难题。然而,最新的消息显示,美国食品药品监督管理局(FDA)已接受了对于Krazati(adagrasib)与Erbitux(cetuximab)联合治疗的补充新药申请(sNDA),并为其进行了优先审查。这一消息为该病型的治疗带来了新的曙光。 FDA优先审查 针对先前接受过治疗的、局部晚期或转移性KRAS G12C突变型结直肠癌(CRC)患者,FDA已接受了Krazati(adagrasib)与Erbitux(cetuximab)联合治疗的补充新药申请(sNDA),并为其进行了优先审查。这一决定是基于KRYST... 查看详情
21
2月
FDA和EMA接受Vorasidenib(AG-881)治疗IDH突变型弥漫性胶质瘤的监管申请
脑胶质瘤是一种罕见而具有挑战性的癌症类型,长期以来,针对这一疾病的治疗方法一直相对滞后。然而,最新的消息带来了令人振奋的希望——美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)已接受并批准了针对IDH突变型弥漫性胶质瘤的新药申请,该药物名为Vorasidenib(AG-881)。这一决定标志着针对这一特定类型脑胶质瘤的新治疗方案有望很快问世,将为患者带来新的曙光。 新药申请获得双重认可 FDA已经接受并批准了Vorasidenib(AG-881)的新药申请,并为其进行了优先审查。与此同时,欧洲药品管理局也已对该药的营销授权申请进行了加速评估。这一认可的背后是来自INDIGO试验的结果... 查看详情
21
2月
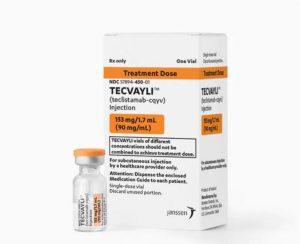
FDA批准TECVAYLI(Teclistamab)2周1次维持治疗复发/难治性多发性骨髓瘤
2024年2月20日,强生公司宣布美国食品和药物管理局(FDA)已经批准了TECVAYLI®(teclistamab-cqyv)的补充生物制剂许可申请(sBLA)。这一决定意味着TECVAYLI®现在可用于维持治疗复发或难治性多发性骨髓瘤(RRMM)患者,给药频率降低至每两周一次,从而为患者提供了更大的治疗方案灵活性。多发性骨髓瘤是一种无法治愈的血癌,给患者及其家庭带来了巨大的负担。因此,这一新的治疗选择对于改善患者的生活质量具有重要意义。 TECVAYLI®获得美国FDA批准 TECVAYLI®是第一个针对多发性骨髓瘤细胞和T细胞的双特异性抗体,通过激活免疫反应来对抗疾病。其获得FDA批准的... 查看详情
20
2月
恩诺单抗(Padcev,Enfortumab)组合在日本获得膀胱癌优先审评
在日本,膀胱癌是一种常见的恶性肿瘤,给患者和医疗专业人员带来了巨大的挑战。然而,随着医学科技的不断进步,越来越多的治疗选择变得可用,给患者带来了希望。最近,一项重要的临床试验为前期未曾接受治疗的晚期或转移性膀胱癌患者带来了新的曙光。此次试验支持了恩诺单抗(Padcev,Enfortumab)与Keytruda(pembrolizumab)的联合应用作为日本膀胱癌患者的前线治疗,引起了日本厚生劳动省的高度关注。 临床试验数据支持优先审查 数据来源于第三期 EV-302 试验,该试验为恩诺单抗(Padcev,Enfortumab)加pembrolizumab联合应用作为日本晚期或转移性膀胱癌患者的... 查看详情
20
2月
FDA接受Datopotamab Deruxtecan治疗经治性晚期非鳞状NSCLC的BLA申请
FDA已接受一份生物制品许可申请(BLA),申请Datopotamab Deruxtecan(Dato-DXd)用于治疗局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)患者。这一举措的背后是来自3期TROPION-Lung01试验(NCT04656652)的数据,该数据显示抗体药物复合物(ADC)与多西他赛在接受过至少一线系统治疗的局部晚期或转移性NSCLC患者中具有显著的进展无病生存(PFS)改善。 试验数据及结果 在TROPION-Lung01试验中,接受Dato-DXd治疗的患者在PFS方面表现出显著改善,而与多西他赛相比,Dato-DXd的中位PFS分别为4.4个月和3.7个月。另外,... 查看详情