15
3月
Agamree(vamorolone,瓦莫罗酮)在美国上市用于治疗杜氏肌营养不良症
近日,生物制药公司Catalyst Pharmaceuticals, Inc. 宣布旗下杜氏肌营养不良症(DMD)治疗药物AGAMREE(vamorolone,瓦莫罗酮)正式在美国上市。这一消息令DMD患者及其家人欣喜,同时也标志着对于这一疾病的治疗方式迈出了新的一步。AGAMREE在2023年10月26日和12月获得了美国食品药品监督管理局(FDA)和欧盟委员会(EC)的批准,而今年1月份,它又相继在英国获批,在德国上市。这也是美国、欧盟和英国批准的第一个杜氏肌营养不良症(DMD)治疗药物。 杜氏肌营养不良症简介 杜氏肌营养不良症(DMD)是一种罕见但危害严重的神经肌肉疾病,通常表现为进行性... 查看详情
15
3月
FDA批准Livmarli(氯马昔巴特)治疗进行性家族性肝内胆汁淤积患者的胆汁淤积性瘙痒症
在医学领域,对于罕见疾病的治疗一直是一个挑战。然而,随着科学技术的不断进步,针对一些少见病的治疗方案也在逐步完善。其中,进行性家族性肝内胆汁淤积(PFIC)就是一种罕见而严重的遗传性疾病,给患者和家庭带来了沉重的负担。然而,近期美国食品和药物管理局(FDA)的一项重大决定为这一疾病的治疗带来了新的曙光。 Livmarli在治疗PFIC患者胆汁淤积性瘙痒症中的重要性 近日,Mirum Pharmaceuticals, Inc.宣布其产品LIVMARLI®氯马昔巴特(maralixibat)口服溶液获得FDA批准,用于治疗胆汁淤积性瘙痒五岁及以上患有进行性家族性肝内胆汁淤积(PFIC)的患者。这一... 查看详情
15
3月
欧盟批准PREVENAR 20用于预防婴儿和儿童肺炎球菌侵袭性疾病
近年来,肺炎球菌感染对婴幼儿的健康构成了严重威胁。在这个领域的持续研究和创新,为我们提供了更多保护婴儿免受这些疾病的有效手段。在这样一个背景下,辉瑞公司最新宣布的消息,为欧盟地区的婴儿和儿童提供了新的保护屏障,这无疑是一个重大的里程碑。PREVENAR 20(20价结合疫苗)的获批,标志着我们在预防肺炎球菌引发的侵袭性疾病、肺炎和急性中耳炎方面迈出了新的一步。 PREVENAR 20的获批 在2024年3月13日,辉瑞公司宣布欧盟委员会已授予其20价肺炎球菌结合疫苗的营销授权。这款疫苗将以PREVENAR 20®的品牌名称在欧盟市场上销售,旨在主动免疫,预防6周至18岁以下的婴儿、儿童和青少年... 查看详情
15
3月
瑞士批准JYNNEOS疫苗(MVA-BN)用于主动免疫18岁及以上成人感染天花和猴痘疾病
在人类与疾病的永恒较量中,疫苗是我们最为可靠的武器之一。2024年3月13日,Bavarian Nordic A/S宣布,瑞士治疗产品局Swissmedic已正式批准JYNNEOS®(MVA-BN)用于主动免疫18岁及以上成人感染天花和猴痘疾病。这一里程碑式的事件,不仅代表着科学技术的进步,更是对全球公共卫生的一次重大胜利。 瑞士批准 疫苗的批准是一项严格的程序,需要经过严谨的审查和评估。这次瑞士的批准是自2019年以来向Bavarian Nordic颁发的首个国家营销授权。更值得注意的是,这一批准得到了瑞士政府针对2022年全球猴痘爆发的便利,这也是对于全球疫情应对机制的一种肯定。在疫情爆发... 查看详情
15
3月
FDA批准Tevimbra(替雷利珠单抗)用于治疗晚期或转移性食管鳞状细胞癌
近日,美国食品药品监督管理局(FDA)批准了一种新的药物——Tevimbra(tislelizumab-jsgr,替雷利珠单抗),作为单药治疗方案,用于治疗晚期或转移性食管鳞状细胞癌(ESCC)患者。这一消息对于许多患者和医疗界来说都是一个重大的突破,标志着癌症治疗领域的又一次重要进展。 Tevimbra(tislelizumab-jsgr)的FDA批准 近日,全球肿瘤公司贝达药业(BeiGene, Ltd.)宣布,美国食品药品监督管理局(FDA)已批准Tevimbra(tislelizumab-jsgr)作为单药治疗方案,用于成年患者,治疗不能手术切除或已转移的食管鳞状细胞癌(ESCC),此... 查看详情
14
3月
FDA授予LYT-200治疗急性髓系白血病的孤儿药资格
美国食品药品监督管理局(FDA)授予了LYT-200在急性髓系白血病(AML)患者治疗中的孤儿药品认定。LYT-200是一种全人源IgG4单克隆抗体,靶向半乳糖凝集素-9(galectin-9),这是白血病细胞中的强效致癌驱动因子和免疫抑制蛋白。 LYT-200的作用机制 LYT-200目前正在进行阶段1临床试验,其中一项是针对复发/难治性、局部晚期或转移性实体瘤患者的试验,另一项是针对复发/难治性AML或高危骨髓增生异常综合征(MDS)患者的试验。这项试验的初步数据表明,LYT-200在实体瘤患者中显示了可接受的安全性和耐受性,并且与抗PD-1抗体结合使用时显示出了初步的抗肿瘤活性。 LYT... 查看详情
14
3月
FDA接受Ensartinib治疗转移性ALK阳性非小细胞肺癌的新药申请
随着科学技术的不断进步,肺癌治疗领域迎来了一项重大突破。近期,美国食品药品监督管理局(FDA)正式接受了一项新药申请,该药物为ensartinib,用于治疗转移性ALK阳性非小细胞肺癌(NSCLC)。这一消息来自Xcovery Holdings的官方公告,为患者和医疗界带来了新的希望。 关键数据和试验结果 eXalt3试验数据支持NDA 该NDA的支持数据来自于eXalt3试验,该试验是一项Ⅲ期临床试验(NCT02767804)。数据显示,接受ensartinib治疗的患者在意向治疗人群中(n = 143)的中位无进展生存期(PFS)为25.8个月(范围,0.03-44.0),而接受crizo... 查看详情
13
3月
TERN-701获得FDA慢性髓系白血病孤儿药物认定
美国食品药品监督管理局(FDA)已将新型药物TERN-701(HS-10382)认定为治疗慢性髓系白血病(CML)患者的孤儿药物。TERN-701是一种特异性的异位BCR-ABL酪氨酸激酶抑制剂,针对BCR-ABL肌酸肪酰化口袋进行作用,为CML患者带来了新的治疗希望。 TERN-701的作用机制与特点 TERN-701是一种作用于BCR-ABL激酶的异位抑制剂,通过靶向BCR-ABL肌酸肪酰化口袋,其作用机制不同于传统的活性位点抑制剂。相较于活性位点抑制剂的局限性,TERN-701在对抗活性位点耐药突变和非特异性作用方面表现出更强的活性,因此可能通过改善肿瘤抑制效果和提高安全性和耐受性来带来... 查看详情
13
3月
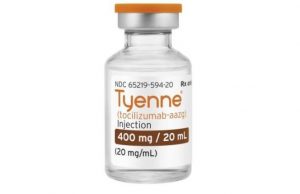
FDA批准tocilizumab生物仿制药Tyenne用于风湿性关节炎
生物仿制药的发展在医药领域引起了广泛关注,其代表着对于昂贵治疗的更加经济有效的替代品。最近,美国食品和药物管理局(FDA)批准了Tyenne(tocilizumab-aazg),这是第二个Actemra(tocilizumab)的生物仿制药,也是首个被批准用于静脉注射(IV)和皮下给药(SC)的tocilizumab生物仿制药。这一新药的批准标志着医疗界在治疗风湿性关节炎等疾病上迈出了一大步。 背景与意义 生物仿制药是生物制品的仿制品,其安全性和有效性与原始产品相似。它们的问世降低了治疗的成本,为患者提供了更多选择,有助于减轻医疗负担。Tyenne的批准为患有中度至重度风湿性关节炎等疾病的患者... 查看详情
13
3月
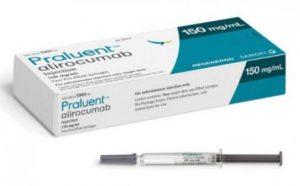
FDA批准Praluent(alirocumab)用于治疗儿童杂合子家族性高胆固醇血症
杂合子家族性高胆固醇血症(HeFH)是一种严重的遗传性疾病,常导致低密度脂蛋白胆固醇(LDL-C)水平升高,增加心血管疾病的风险。对于儿童患者而言,治疗的挑战更为严峻,特别是对于那些对常规他汀类药物治疗无效或不耐受的患者。然而,随着科学技术的不断进步,新的治疗选择正在不断涌现。近日,美国FDA批准了Praluent(alirocumab,阿利西尤单抗)的扩展适应症,将其用于治疗8岁及以上的HeFH儿童患者,为这一患者群体带来了新的希望和可能性。 HeFH的挑战 杂合子家族性高胆固醇血症(HeFH)作为一种常染色体显性遗传疾病,其主要特征是LDL-C浓度的显著升高。若未及时治疗,患者可能发展成早... 查看详情