24
4月
加拿大卫生部批准皮下注射阿特珠单抗用于治疗肺癌、乳腺癌和肝癌
在癌症治疗的道路上,科学家和医生们不断寻找创新的方法来改善患者的生存率和生活质量。最近,加拿大卫生部的一项重要决定给了肺癌、乳腺癌和肝癌患者带来了新的曙光。皮下注射阿特珠单抗的批准为癌症治疗领域带来了重大的突破。本文将介绍这一重要决定的背景、研究结果以及对患者和医疗服务的积极影响。 皮下注射阿特珠单抗的批准 加拿大卫生部已批准使用皮下注射形式的阿特珠单抗(Atezolizumab,Tecentriq)用于肺癌、乳腺癌或肝细胞癌(HCC)患者的治疗,前提是静脉注射(IV)形式已获批准。这一市场授权得到了IMscin001试验第1b/3阶段第2部分的数据支持,该试验显示与静脉注射相比,皮下注射阿特... 查看详情
24
4月
Tizveni(Tislelizumab)获欧盟批准用于一线和二线非小细胞肺癌的3个适应症
Tizveni(Tislelizumab) 已在欧洲获批用于一线和二线治疗的 3 个适应症,用于特定非小细胞肺癌患者。 欧洲委员会已批准Tislelizumab (商品名:Tizveni)在三个适应症中,适用于成人非小细胞肺癌(NSCLC)的一线和二线治疗。这三个NSCLC适应症包括以下内容: 与卡铂和紫杉醇或纳米紫杉醇(阿伯希因)联合用于对于不宜行手术切除或接受铂类化疗放疗治疗的局部晚期鳞状细胞NSCLC成人患者,或对于转移性疾病的患者的一线治疗。 与培美曲塞和含铂化疗联合用于对于肿瘤PD-L1表达至少达到50%的非鳞状细胞NSCLC成人患者的一线治疗,且患者无EGFR或ALK突变。患者需患... 查看详情
24
4月
FDA批准Lutathera用于治疗儿童SSTR阳性胃肠胰神经内分泌肿瘤
在医学领域,儿童罹患胃肠胰神经内分泌肿瘤(GEP-NETs)虽然罕见,但其对患儿及其家庭的影响却可能是毁灭性的。然而,针对这一患者群体的治疗选择却一直相对匮乏。然而,近日,美国食品药品监督管理局(FDA)的一项重大决定可能会改变这一现状。FDA正式批准了Lutathera(Lutetium Lu 177 Dotatate)用于12岁及以上患有SSTR阳性GEP-NETs的儿童患者,这一决定标志着儿科医学领域的一项重大突破。 Lutathera的FDA批准 FDA已批准Lutathera用于12岁及以上患有生长抑素受体(SSTR)阳性胃肠胰神经内分泌肿瘤(GEP-NETs)的儿童患者,包括前肠、... 查看详情
24
4月
FDA批准Ojemda(Tovorafenib)治疗儿童复发/难治性BRAF+低级别胶质瘤
儿童脑幼稚性低级别胶质瘤是一种相对少见但严重的儿童神经系统肿瘤。对于这种肿瘤的治疗一直是一个挑战,尤其是对于已复发或难治性的患者。然而,一项新的突破性治疗获得了美国食品药品监督管理局(FDA)的加速批准,这将为这一患者群体带来新的希望和选择。 近日,美国食品药品监督管理局(FDA)宣布已对Ojemda(Tovorafenib)进行了加速批准,用于治疗6个月及以上年龄段的儿童,这些患者患有复发或难治性低级别胶质瘤,并携带BRAF融合/重排或BRAF V600突变。 这一决定标志着该药物成为首个针对携带BRAF重排,包括融合的儿童低级别胶质瘤的系统治疗药物。 临床试验数据支持批准决定 这一决定得到... 查看详情
24
4月
欧盟批准Emblaveo(aztreonam-avibactam)用于治疗多重耐药感染和选择有限的患者
近年来,多重耐药感染的问题在全球范围内日益凸显,给医疗系统和公共卫生带来了严重挑战。在这一背景下,辉瑞(Pfizer)与艾伯维(AbbVie)的合作项目,Emblaveo(aztreonam-avibactam)的问世,成为了一线希望。这不仅是对抗多重耐药革兰氏阴性菌的创新药物,更是对全球抗菌素耐药性问题的积极应对。 Emblaveo的批准与应用领域 2024年04月22日,欧盟委员会正式批准了Emblaveo的上市,这标志着这一新药物的正式进入市场。Emblaveo的适用范围涵盖了成人复杂性腹腔内感染、医院获得性肺炎以及复杂性尿路感染等疾病。尤其值得注意的是,Emblaveo是针对治疗由多重... 查看详情
23
4月
欧盟委员会批准Carvykti(Cilta-Cel)用于治疗至少1线治疗后的复发/难治性骨髓瘤
在癌症治疗领域,寻找更有效的治疗方案一直是医学界的追求目标。近日,一项重要的决定再次将治疗多发性骨髓瘤的战略推向前进,欧盟委员会正式批准了 Cilta-Cel(商品名:Carvykti)的扩展适应症,用于治疗复发/难治性多发性骨髓瘤,这为曾经治疗过至少一种前线疗法的患者带来了新的希望。 关键研究结果 这一决定是基于 Cilta-Cel 在 CARTITUDE-4 临床试验中的积极表现而做出的。这项研究显示,在已经接受过 1 至 3 种前线治疗的复发/难治性多发性骨髓瘤患者中,Cilta-Cel 的治疗效果非常显著。在中位随访时间达到 15.9 个月后,Cilta-Cel 治疗组的疾病进展或死亡... 查看详情
23
4月
FDA授予Ziftomenib治疗NPM1突变急性髓系白血病的突破性疗法资格
在白血病治疗领域,FDA最近授予了Ziftomenib药物突破性疗法认定,用于治疗NPM1突变型急性髓系白血病(AML)。这一认定将这种药物标志为第一种被认定为NPM1突变型AML突破性疗法的调查性治疗方法,对于已接受过大量治疗但仍存在复发/难治性NPM1突变型AML患者的治疗具有重要意义。 Ziftomenib的治疗潜力 Ziftomenib是一种口服药物,每日一次,可靶向menin-KMT2A/MLL蛋白质相互作用,用于治疗基因定义的AML患者,这类患者存在着严重的治疗需求。在KOMET-001试验(NCT04067336)的1/2期中,该新药的治疗安全可控,且在每日600毫克的剂量下观察... 查看详情
23
4月
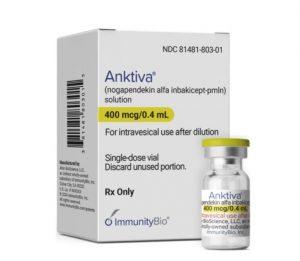
FDA批准Anktiva与卡介苗(BCG)联合治疗非肌层浸润性膀胱癌
非肌层浸润性膀胱癌(NMIBC)是一种常见的膀胱癌类型,其中部分患者对常规治疗如卡介苗(BCG)治疗不敏感。近期,美国食品药品监督管理局(FDA)批准了一种新的治疗方案,将Anktiva(Nogapendekin Alfa Inbakicept-pmln;N-803)与BCG联合应用于对BCG不敏感的NMIBC患者,为这一患者群体带来了新的希望。 新的治疗方案:Anktiva与BCG联合治疗 美国食品药品监督管理局(FDA)已批准了将Anktiva与卡介苗(BCG)联合应用于对BCG不敏感的非肌层浸润性膀胱癌(NMIBC)患者的治疗。该治疗方案主要针对合并有原位癌(CIS)的患者,无论是否伴有... 查看详情
23
4月
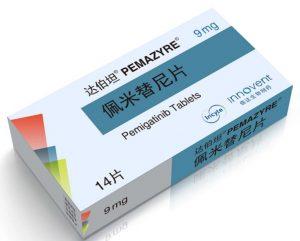
达伯坦(佩米替尼,Pemazyre)治疗FGFR2融合或重排的胆管癌在澳门获批
胆管癌作为一种少见而凶险的癌症,一直以来都是医学界面临的挑战之一。然而,近年来,随着分子靶向治疗的不断发展,一些新药物的问世给患者带来了新的希望。在这样的背景下,达伯坦(佩米替尼/培美替尼,Pemazyre,Pemigatinib)作为一种针对胆管癌的新型治疗药物,近日在中国澳门获得了药物监管部门的批准,这将为某一亚型的胆管癌患者带来新的治疗选择。 胆管癌的治疗挑战与新的希望 胆管癌是一种少见但危险的癌症,其治疗一直是医学界的难题之一。在过去,传统的化疗和放疗对于胆管癌的治疗效果并不理想,患者的生存率较低,生存质量也难以得到有效提升。然而,随着分子生物学和基因组学研究的深入,人们逐渐发现了一些... 查看详情
19
4月
FDA批准Lumisight和Lumicell DVS用于残留乳腺癌检测
随着医学技术的不断进步,对于癌症的早期检测和治疗变得越来越准确和有效。然而,即使在手术过程中,有时也难以完全切除癌组织,这可能导致病人需要额外的手术来处理残余的癌细胞。在这样的背景下,光学成像技术的应用正在取得突破,以帮助医生更精确地定位和切除残余的癌细胞。最近,美国食品药品监督管理局(FDA)批准了 Lumisight 和 Lumicell DVS 用于乳腺癌残余癌细胞检测,这一决定将为乳腺癌手术带来新的希望。 Lumisight 和 Lumicell DVS 的批准意义 Lumisight(吡格利西汀)和 Lumicell DVS 被FDA批准用于成人乳腺癌患者的荧光成像,作为乳腺保留手术... 查看详情