04
7月
FDA授予Radspherin用于治疗卵巢癌腹膜转移的快速通道认证
近日,美国食品药品监督管理局(FDA)授予Radspherin用于治疗卵巢癌腹膜转移的快速通道认证,这标志着这一创新疗法在癌症治疗领域的重要突破。Radspherin是一种alpha辐射微粒悬浮液,专为局部治疗体腔内的转移性癌症而设计。与传统的全身治疗不同,Radspherin通过在目标体腔内注入放射性微粒,提供局部放射药物治疗,从而将辐射暴露限制在癌变区域,最大限度地减少对健康组织的影响。这种独特的治疗方式不仅提高了治疗的精准性,还显著减少了副作用。 临床试验与安全性分析 在正在进行的RAD-18-001临床试验中,Radspherin显示出良好的耐受性,且在推荐剂量7MBq下未发现剂量限制... 查看详情
04
7月
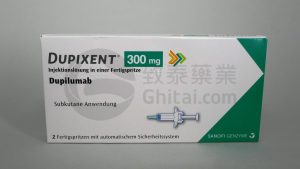
度普利尤单抗(Dupixent,达必妥)治疗慢性阻塞性肺疾病在欧盟获批
2024年7月3日,全球制药巨头赛诺菲与再生元联合宣布,他们共同研发的度普利尤单抗dupilumab(Dupixent,达必妥)获得了欧洲药品管理局(EMA)的批准,用于治疗那些以血嗜酸性粒细胞水平升高为特征的难治性慢性阻塞性肺病(COPD)患者。这个消息为那些在传统治疗方法上未能得到有效控制的患者带来了新的希望。 一、新的治疗选择:度普利尤单抗的批准 此次批准的背后是BOREAS和NOTUS两项关键研究的积极结果。这两项研究分别在939名和935名患者中展开,显示出度普利尤单抗在减少COPD急性发作频次和改善肺功能方面的显著效果。在BOREAS研究中,度普利尤单抗组患者在52周内的中重度CO... 查看详情
03
7月
替雷利珠单抗(Tevimbra)联合化疗显著延长食管鳞状细胞癌患者的总生存期
食管鳞状细胞癌(ESCC)是一种侵袭性很强的恶性肿瘤,治疗选择有限,预后较差。近年来,免疫治疗在多种癌症中的应用取得了显著进展。RATIONALE-306试验是一项全球性、随机、双盲的III期临床试验,旨在评估替雷利珠单抗Tislelizumab(Tevimbra)联合化疗与安慰剂联合化疗在局部晚期不可切除或转移性ESCC患者中的疗效和安全性。本试验中,替雷利珠单抗(Tevimbra)的加入是否能够显著延长患者的总生存期(OS)成为研究的核心问题。 研究设计与方法 在RATIONALE-306试验中,患者被随机分为两组,一组接受每三周一次的替雷利珠单抗(Tevimbra)(200mg)联合化疗... 查看详情
03
7月
Kisunla(donanemab-azbt,多纳单抗)用于治疗早期症状性阿尔茨海默病获FDA批准
礼来公司(Eli Lilly and Company)在7月2日宣布,美国食品药品监督管理局(FDA)已批准其研发的药物Kisunla(多纳单抗,donanemab-azbt)用于治疗出现早期症状的阿尔茨海默病(AD)患者。Kisunla适用于轻度认知障碍(MCI)和轻度痴呆阶段的阿尔茨海默病患者,并且需要确认患者存在淀粉样蛋白病理。预计Kisunla将在未来几周内上市。 阿尔茨海默病的病理特点 阿尔茨海默病是一种不可逆的渐进性脑部疾病,其具体病因尚不完全明确。然而,研究表明,这种疾病的一个显著特征是大脑中β淀粉样蛋白斑块的积聚。这些β类淀粉样蛋白会堆积形成斑块,进而导致与阿尔茨海默病相关的记... 查看详情
03
7月
Crinecerfont治疗先天性肾上腺增生症获FDA优先审查
近日,Neurocrine Biosciences, Inc.宣布,美国FDA已接受其新药Crinecerfont的两项新药申请,并授予其优先审查资格。该药物旨在治疗典型先天性肾上腺增生症(CAH)的儿童、青少年和成人,分别针对胶囊和口服溶液两种剂型。预计FDA将在2024年12月底完成审批,为这种罕见的遗传疾病带来新的治疗希望。 先天性肾上腺增生症(CAH)的现状 先天性肾上腺增生症(CAH)是一种由遗传突变引起的罕见疾病,主要表现为体内关键酶的缺乏,导致肾上腺激素生产的异常。约95%的CAH病例是由21-羟化酶(21-OHD)缺乏引起的。这种酶缺乏使得患者无法正常生产皮质醇和醛固酮,从而引... 查看详情
03
7月
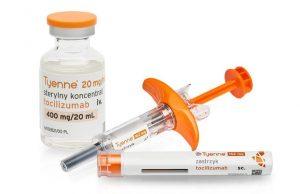
Tyenne皮下制剂(托珠单抗生物仿制药)在美国上市
近年来,生物制药领域的迅猛发展为患者提供了更多的治疗选择。作为其中的一个重要成果,Tyenne(tocilizumab-aazg)成为Actemra(tocilizumab,托珠单抗)的生物仿制药,不仅在静脉(IV)给药方面有所应用,如今更拓展至皮下(SC)给药。Tyenne也因此成为美国FDA批准的首个同时具有静脉和皮下制剂的托珠单抗生物仿制药。这一创新标志着治疗手段的进一步多样化,为患者带来了更多的便利和选择。 皮下制剂的突破 2024年3月,美国FDA正式批准Tyenne的静脉和皮下给药方式。这一批准基于一项关键的3期研究(ClinicalTrials.gov标识符:NCT0451200... 查看详情
02
7月
乌司奴单抗Stelara的生物类似药Pyzchiva(ustekinumab-ttwe)获FDA批准
2024年7月1日,位于巴塞尔的全球领先的仿制药和生物仿制药制造商山德士公司宣布,其新型生物仿制药Pyzchiva®(ustekinumab-ttwe)获得了美国食品药品监督管理局(FDA)的批准。此次批准涵盖了45毫克/0.5毫升和90毫克/毫升预填充注射器,用于皮下注射,以及130毫克/26毫升(5毫克/毫升)单剂量小瓶,用于静脉输注。Pyzchiva®由三星Bioepis公司研发,并将在美国由山德士负责商业化。值得注意的是,FDA还初步判定Pyzchiva®可以与其参比药物互换,这对于尚未过期的首个可互换生物仿制药生物产品具有重要意义。 上市计划与市场前景 山德士计划于2025年2月在美... 查看详情
02
7月
Tepkinly(Epcoritamab)获得CHMP关于复发/难治性滤泡性淋巴瘤的正面意见
欧洲药品管理局(EMA)药物评审委员会(CHMP)近期宣布,对Tepkinly(Epcoritamab)给予有条件上市许可的正面意见。该药物将作为单药治疗方案,适用于至少经历过两种系统治疗方案后复发或难治性滤泡性淋巴瘤(FL)患者。 正面意见与审批背景 EMA的正面意见是基于EPCORE-NHL-1临床试验(Study GCT3013-01; NCT03625037)阶段1/2的数据,该试验显示,Tepkinly(Epcoritamab)在复发/难治性滤泡性淋巴瘤患者中总有效率(ORR)为82.0%(95% CI,74.1%-88.2%),完全缓解率(CR)为60.0%(95% CI,50.8... 查看详情
02
7月
度伐单抗(Imfinzi)联合奥拉帕利(Lynparza)治疗pMMR晚期或复发性子宫内膜癌即将获欧盟批准
近年来,随着癌症治疗技术的不断进步,子宫内膜癌的治疗方法也在不断更新。传统的治疗手段如手术、放疗和化疗虽然在一定程度上能够延长患者的生存期,但对于晚期或复发性子宫内膜癌患者来说,预后仍然不甚理想。针对这种现状,欧洲药品管理局药品上市委员会(CHMP)最近推荐了一种新的治疗方案,即度伐单抗Durvalumab(Imfinzi)联合化疗后再加奥拉帕利Olaparib(Lynparza)和度伐单抗(Imfinzi)的治疗方案,用于错配修复正常(pMMR)的初治晚期或复发性子宫内膜癌患者。此外,对于错配修复缺陷(dMMR)的患者,CHMP推荐使用度伐单抗(Imfinzi)联合化疗后单药度伐单抗(Imf... 查看详情
02
7月
JERAYGO(Aprocitentan)用于治疗难治性高血压获欧盟批准
2024年7月1日,Idorsia Ltd宣布,欧盟委员会(EC)已经批准了JERAYGO™(aprocitentan)用于治疗成人难治性高血压。此药物需与至少三种其他抗高血压药物联合使用。建议的剂量为每天一次12.5毫克口服。如果患者能够耐受12.5毫克的剂量并需要更严格的血压控制,则剂量可增加到每天一次25毫克。 JERAYGO™:独特的内皮素受体拮抗剂 JERAYGO™(aprocitentan)获得欧盟委员会的批准,成为第一个也是唯一一个用于治疗难治性高血压的内皮素受体拮抗剂(ERA)。这一批准标志着治疗难治性高血压的新进展,为那些现有治疗方案无法有效控制血压的患者提供了新的希望。 P... 查看详情