28
7月
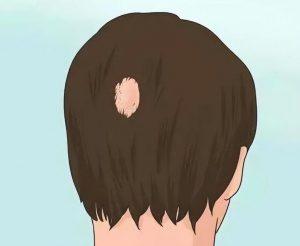
LEQSELVI(Deuruxolitinib)治疗严重斑秃获FDA批准
2024年7月25日,太阳制药工业有限公司宣布其药品LEQSELVI™(deuruxolitinib)8mg片剂已获美国食品药品监督管理局(FDA)批准,用于治疗严重斑秃的成年人。 临床试验验证 此次批准基于两项多中心、随机、双盲、安慰剂对照的三期临床试验THRIVE-AA1和THRIVE-AA2的结果。这两项试验共招募了1220名斑秃患者,这些患者的头皮脱发率至少为50%,脱发时间超过六个月。试验还包括两项开放标签、长期延长试验,参与者在完成24周的试验后可继续入组。 在试验开始时,患者的头皮毛发覆盖率平均仅为13%。在24周后,超过30%的患者头皮毛发覆盖率达到80%或更高(SALT ≤2... 查看详情
28
7月
Skyrizi(risankizumab)治疗中重度活动性溃疡性结肠炎在欧盟获批
2024年7月26日,艾伯维公司在伊利诺伊州北芝加哥宣布,欧盟委员会已正式批准Skyrizi(risankizumab)用于治疗中度至重度活动性溃疡性结肠炎(UC)的成年患者。这些患者需要符合以下条件:对常规疗法或生物制品应答不足、失去应答或不耐受。这一批准标志着Skyrizi在欧盟的第四项适应症获批。 临床试验结果支持新适应症 Skyrizi此次获批的重要依据是基于两项3期临床试验INSPIRE和COMMAND的研究成果。根据此前发布的COMMAND试验结果,接受180 mg和360 mg Skyrizi治疗的患者,在52周时达到了显著的临床缓解。具体数据显示,180 mg剂量组的患者有40... 查看详情
27
7月
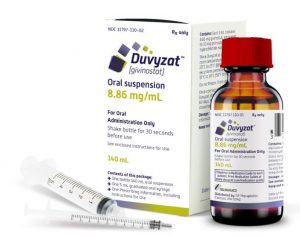
Duvyzat(吉维诺司他)治疗杜氏肌营养不良症现已在美上市
近日,ITF Therapeutics宣布其创新药物Duvyzat(givinostat,吉维诺司他)口服混悬液正式在美国上市。此药专为6岁及以上的杜氏肌营养不良症(DMD)患者设计,是首个获FDA批准用于治疗所有DMD遗传变异患者的非类固醇药物,标志着DMD治疗领域的重要突破。 Duvyzat的成分与作用机制 Duvyzat的主要成分为组蛋白去乙酰化酶(HDAC)抑制剂givinostat盐酸盐一水合物。DMD是一种由于缺乏肌营养不良蛋白而导致的肌肉退化疾病,而Duvyzat通过调节HDAC的失调活性来应对这一问题。尽管其具体作用机制尚不完全明确,但研究表明,givinostat能够抑制HD... 查看详情
27
7月
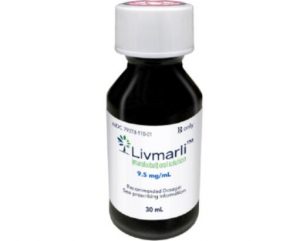
Livmarli药物在美获批用于12个月及以上的进行性家族性肝内胆汁淤积症儿科患者治疗
近日,Mirum制药公司宣布,美国食品药品监督管理局(FDA)扩大了Livmarli (maralixibat,氯马昔巴特)口服溶液的适应症范围,现在包括了12个月及以上的进行性家族性肝内胆汁淤积症(PFIC)患者的胆汁淤积性瘙痒治疗。此前,Livmarli仅被批准用于至少5岁的PFIC患者。这一批准标志着PFIC患者治疗的新纪元,为更多年龄段的患者带来了新的希望。 PFIC疾病概述 进行性家族性肝内胆汁淤积症(PFIC)是一种罕见的遗传性肝病,由基因突变引起。根据具体的基因突变类型,PFIC可以分为不同的亚型。然而,这些亚型的共同特征是胆汁流动减慢或停止,这一现象被称为胆汁淤积。胆汁淤积会导... 查看详情
26
7月
首款口腔崩解片口服避孕药Femlyv获得FDA批准
美国食品药品管理局(FDA)近日批准了一种新型的复方口服避孕药Femlyv(norethindrone acetate and ethinyl estradiol,醋酸炔诺酮和炔雌醇),这是一种口腔崩解片(ODT)形式的药物。它包含醋酸炔诺酮和炔雌醇两种活性成分,主要针对那些有吞咽困难的人群。此药物的批准标志着避孕药物形式的一大进步,特别是在提高药物的使用便利性和患者的依从性方面。 Femlyv的成分与机制 Femlyv由24片绿色圆形ODT组成,每片含有1mg醋酸炔诺酮和0.020mg炔雌醇,此外还有4片白色圆形惰性ODT。这些成分分别为孕激素和雌激素,自1968年以来已经在美国以可吞咽片剂... 查看详情
26
7月
FDA授予Ozuriftamab Vedotin(CAB-ROR2-ADC,BA3021)治疗头颈部鳞状细胞癌的快速通道资格
近日,FDA授予Ozuriftamab Vedotin(CAB-ROR2-ADC;BA3021)用于治疗复发或转移性头颈部鳞状细胞癌(HNSCC)的快速通道资格。这种靶向ROR2的抗体药物偶联物(ADC)目前正在进行BA3021-002(NCT05271604)二期临床试验的评估。该药物特别针对在接受铂基化疗和PD-(L)1抑制剂治疗后疾病进展的患者。 二期临床试验BA3021-002的详细信息 BA3021-002试验是一项多中心、开放标签、单臂的二期临床试验,旨在评估Ozuriftamab Vedotin在治疗复发或转移性HNSCC患者中的安全性和有效性。研究纳入了33名患者,这些患者在试... 查看详情
26
7月
FDA重新受理Cosibelimab用于局部晚期或转移性皮肤鳞状细胞癌的生物制品许可证申请
美国食品药品监督管理局(FDA)已经接受了Cosibelimab(CK-301)生物制品许可证申请(BLA)的重新提交。此申请旨在获得批准,用于治疗无法接受根治性手术或放疗的局部晚期或转移性皮肤鳞状细胞癌(CSCC)患者。 重新提交的背景与原因 2023年12月,FDA曾发出完整回应信(CRL),指出与Cosibelimab的第三方合同制造组织多方检查有关的问题,但未对临床数据、安全性或标签提出任何质疑。2024年6月,Checkpoint Therapeutics公司宣布已与FDA达成一致,制定了解决这些问题的策略,促使BLA得以重新提交。最终,BLA在2024年7月2日重新提交,并被FDA... 查看详情
26
7月
多塔利单抗(Jemperli)治疗dMMR/MSI-H子宫内膜癌在加拿大获得全面批准
在2021年12月,加拿大卫生部曾为多塔利单抗dostarlimab-gxly(商品名:Jemperli)用于治疗复发性或晚期错配修复缺陷(dMMR)或微卫星不稳定(MSI-H)子宫内膜癌的成年患者颁发了有条件的合规通知(NOC/c)。这些患者已经在接受铂类药物治疗后出现病情进展。此后,新的临床数据支持了该药物的全面批准。 全面批准的依据 此次全面批准基于GARNET试验(NCT02715284)A1扩展队列的进一步数据。长期研究结果显示,在患有dMMR/MSI-H子宫内膜癌的患者中,确认的客观缓解率(ORR)为45.5%(95% CI,37.1%-54.0%)。在中位随访27.6个月时,缓解... 查看详情
26
7月
Brineura(Cerliponase-alfa)治疗儿童2型神经元蜡样脂褐质沉积症获FDA批准
近日,BioMarin Pharmaceutical Inc. 宣布,美国食品药品监督管理局 (FDA) 批准了该公司的补充生物制品许可申请 (sBLA),用于治疗患有CLN2(2型神经元蜡样脂褐质沉积症,也称为三肽基肽酶 1 (TPP1) 缺乏症)的所有年龄段儿童。这一决策标志着Brineura(Cerliponase alfa)从仅适用于3岁及以上的CLN2患者,扩展到适用于所有年龄段的患者,无论其是否有症状或处于症状前期。 扩展适应症的背景与研究数据 此前,Brineura 仅适用于晚期婴儿CLN2疾病的有症状儿童,而新的适应症涵盖了所有年龄段的CLN2患者。这一扩展得益于190-203... 查看详情
25
7月
Zituvimet XR 获得FDA批准用于治疗2型糖尿病
近日,Zydus Lifesciences Limited(包括其子公司/附属公司,以下简称“Zydus”)宣布其新药申请(NDA)获得美国食品药品监督管理局(FDA)最终批准,可以在美国市场销售Zituvimet XR(sitagliptin和metformin hydrochloride)缓释片。这一批准标志着Zydus在sitagliptin(基础药物)及其组合药物领域的三项新药申请均通过了505(b)(2)途径获得批准,且全部在第一次审查周期内获得批准(FCA)。 Zituvimet XR的适应症和生产基地 Zituvimet XR(sitagliptin和metformin hydr... 查看详情