04
7月
英国启动试点以改善肥胖药物的获取
英国启动了一项耗资 4000 万英镑(5044 万美元)的试点,以扩大获得包括 Wegovy 在内的肥胖药物的机会。为期两年的试点旨在让医院外的患者更容易获得最新、最有效的肥胖药物。这将有助于减少患有与体重相关疾病的人数,从而减少等待名单。美国国家健康与护理卓越研究所 (NICE) 建议体重指数 (BMI) 至少为 35 且存在一种与体重相关的健康状况(如糖尿病或高血压)的成年人使用Wegovy品牌的索马鲁肽压力。 然而,Wegovy 只能通过主要在医院的专业体重管理服务提供。这意味着只有 35,000 人可以获得该药物,结合饮食、体力活动和行为支持,可以帮助人们在一年内减轻多达 15% 的体... 查看详情
04
7月
在中期研究中,礼来公司每日服用的药物可使体重减轻 15%,与未注射的 Wegovy 结果相媲美
礼来公司的实验性减肥药在中期试验中使用最高剂量的 36 周后,帮助人们平均减轻了 15% 的体重,与目前批准的 Wegovy 等注射疗法的长期效果相媲美。研究人员周五在《新英格兰医学杂志》上发表的一项研究报告 称,这种药物 Orforglipron 与该类药物(称为 GLP-1 受体激动剂)具有相似的副作用:主要是恶心、便秘和呕吐等胃肠道反应。礼来公司资助的试验结果也在圣地亚哥举行的美国糖尿病协会会议上公布。目前批准的减肥药物,如诺和诺德的 Wegovy,每周注射一次。诺和诺德 (Novo Nordisk) 的 Ozempic 含有与 Wegovy 相同的关键成分 semaglutide,而礼... 查看详情
23
6月
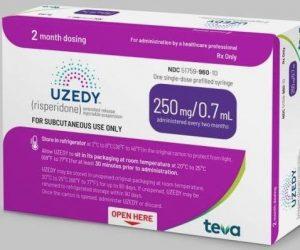
UZEDY 数据显示延长了精神分裂症患者的复发时间
梯瓦制药公司 (Teva Pharmaceuticals) 宣布,其神经科学组合中的四项研究将于 2023 年 5 月 20 日至 24 日举行的 2023 年美国精神病学协会 (APA) 年会上公布。摘要包括 UZEDY(利培酮)的数据,这是一种缓释注射混悬液用于皮下注射,最近已被 FDA 批准用于治疗成人精神分裂症。我们还将介绍其他摘要,包括影响 DT 诊断的特征数据以及用于识别 DT 独特患者群体的机器学习。 TD 是一种慢性运动障碍,四分之一接受某些心理健康治疗的人都会受到影响。在所提供的数据中,Teva 将分享两项支持 FDA 批准 UZEDY 的试验结果,即 RISE 研究(利培酮... 查看详情
22
6月
TEVA梯瓦公司推出新的“转向增长”战略
以色列特拉维夫–(美国商业资讯)–梯瓦制药工业有限公司(纽约证券交易所和特拉维夫证券交易所代码:TEVA)今天宣布了一项新的战略框架,该框架包含四大支柱,旨在使公司进入新的增长时代。该战略旨在通过 AUSTEDO ®、 AJOVY ®、UZEDY和生物仿制药扩大了其创新产品线,维持其仿制药实力并专注于业务。这四大支柱预计将为患者带来更高的价值并产生更大的影响。 Teva 总裁兼首席执行官 Richard Francis表示:“我们的新战略建立在四个关键支柱之上,通过我们的商业产品组合和生物仿制药、创新管道、仿制药巨头和集中的资本配置实现短期和长期增长。 ” “通过我们的... 查看详情
22
6月
MedinCell:mdc-TJK(Teva 的代号:TEV-44749)1 期研究药代动力学由 Teva 在 SIRS 2023 上首次展示
MedinCell 的合作伙伴 Teva Pharmaceuticals在 2023 年精神分裂症研究协会 (SIRS) 上发表一份原始报告,描述奥氮平长效皮下制剂(mdc-TJK 或 TEV-44749)的药代动力学特征。 将提供的数据来自一项 127 名参与者的 1 期临床研究,该研究评估了单次递增剂量 mdc-TJK (TEV-44749) 在健康志愿者中的药代动力学,以及在精神分裂症患者中每月一次和多次剂量的药代动力学或分裂情感障碍。注射后,mdc-TJK (TEV-44749) 在一天内达到治疗浓度,并在整个 28 天的给药间隔内维持该浓度。 mdc-TJK (TEV-44749) ... 查看详情
21
6月
Teva 和 MedinCell 的合作關係
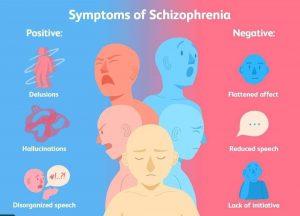
关于精神分裂症 精神分裂症是一种慢性、进行性和严重使人衰弱的精神障碍,影响一个人的思维、感觉和行为。患者会出现一系列症状,其中可能包括妄想、幻觉、言语或行为紊乱以及认知能力受损。世界上大约 1% 的人口会在其一生中患上精神分裂症,目前在美国有 350 万人被诊断出患有这种疾病。尽管精神分裂症可以发生在任何年龄,但男性的平均发病年龄往往在十几岁到 20 岁出头,而女性则在 20 多岁到 30 岁出头。精神分裂症的长期病程以部分或完全缓解被复发打破为特征,这通常发生在精神科急症的情况下,需要住院治疗。大约 80% 的患者在治疗的前五年经历了多次复发,每次复发都会带来功能丧失、治疗难治和脑形态改变的... 查看详情
21
6月
Teva 和 MedinCell 宣布 FDA 批准 UZEDY™(利培酮)缓释注射混悬液,一种长效皮下非典型抗精神病注射液,用于 治疗成人精神分裂症
新泽西州帕西帕尼、特拉维夫和巴黎,2023 年 4 月 28 日– Teva Pharmaceutical Industries Ltd.(纽约证券交易所和 TASE:TEVA)的美国子公司 Teva Pharmaceuticals 和 MedinCell(泛欧交易所代码:MEDCL)今天宣布,美国食品和药物管理局(FDA) 已批准 UZEDY(利培酮)缓释可注射混悬液用于治疗成人精神分裂症。UZEDY 是利培酮的第一个皮下长效制剂,它利用 SteadyTeq™,MedinCell 专有的一种共聚物技术,可控制利培酮的稳定释放。单次给药后 6-24 小时内可达到治疗血药浓度。 “UZEDY 体... 查看详情
20
6月
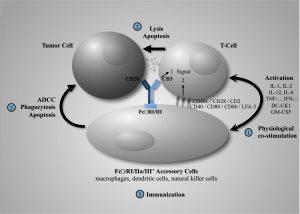
Genentech 提供了新数据,证明 Glofitamab 和 Mosunetuzumab 作为固定期限、现成的淋巴瘤治疗方案的潜力
在 2022 年 12 月 10 日至 13 日举行的第 64 届美国血液学会 (ASH) 年会和博览会上进行了介绍。研究性双特异性 glofitamab 在复发或难治性 (R/R) 大 B-细胞淋巴瘤 (LBCL) 表明 glofitamab 有可能成为第一个现成的 CD20xCD3 T 细胞结合双特异性抗体,可以在固定的时间内给予患有严重预处理的侵袭性淋巴瘤的人。这些数据将在会上呈现,并同步在线发布于新英格兰医学杂志 (NEJM)。此外,mosunetuzumab 的更新数据继续证明在经过大量预处理的滤泡性淋巴瘤 (FL) 患者中具有临床意义的结果。Mosunetuzumab 是一种固定疗... 查看详情
20
6月
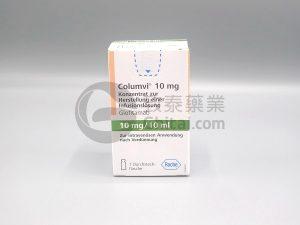
FDA 批准基因泰克(Genentech)的 Columvi,这是第一个也是唯一一个对复发或难治性弥漫性大 B 细胞淋巴瘤患者进行固定疗程治疗的双特异性抗体
加利福尼亚州南旧金山–( BUSINESS WIRE )–(美国商业信息)–罗氏集团 (6: RO, ROG; OTCQX: RHHBY) 的成员基因泰克 (Genentech) 今天宣布,美国食品和药物管理局 (FDA) 已批准 Columvi ®(glofitamab-gxbm) 用于治疗复发或难治性 (R/R) 未另行说明的弥漫性大 B 细胞淋巴瘤 (DLBCL) 或由滤泡性淋巴瘤引起的大 B 细胞淋巴瘤 (LBCL) 的成年患者,经过两次或两次以上治疗系统治疗线。该适应症根据 I/II 期 NP30179 研究中的反应率和反应持久性获得加速批准。对该... 查看详情
20
6月
全球双特异性抗体市场机会和临床试验洞察 2023 报告
基于抗体的疗法的引入已经改变了癌症治疗领域的游戏规则。单克隆抗体已经存在了几十年,并且仍然发挥着如此重要的作用。然而,随着临床上未满足的医疗需求不断增加,目前的工作重点是开发这些生物制剂的先进形式。抗体生物制品研发的持续扩张带来了双特异性抗体时代。 这些双特异性抗体能够参与或靶向两个不同的目标,因此能够同时执行多种操作,包括:将免疫细胞引导至肿瘤细胞,同时阻断两种不同的途径并传递细胞毒性有效载荷。在过去的几十年里,双特异性抗体的生产遇到了很多困难;尽管如此,它们已显示出作为有前途的癌症疗法的巨大潜力。 双特异性抗体是一种快速发展的工程生物制品,显著改善了未满足的重大医疗需求。Columvi 的... 查看详情