03
12月
全液态脑膜炎球菌疫苗Menveo获得欧盟委员会批准
脑膜炎球菌性疾病(IMD)是一种由脑膜炎球菌引起的严重传染病,虽然这种疾病相对罕见,但一旦发生往往会迅速引发严重后果,包括脑膜炎、败血症等,甚至可能导致长期的神经损伤、截肢和听力丧失等不可逆损害。对于这些高风险人群,及时接种疫苗成为预防脑膜炎球菌感染的重要手段。近期,全球制药公司GSK(葛兰素史克)推出的全液态脑膜炎球菌疫苗Menveo获得了欧盟委员会(EC)的批准,旨在为2岁及以上的人群提供更便捷的免疫保护。 疫苗新形式的批准与简化接种流程 此次获批的全液态版本Menveo疫苗采用单瓶包装,设计上旨在简化疫苗的接种过程。与传统需要混合溶液的粉末型疫苗不同,新的液态疫苗可以直接使用,无需接种前... 查看详情
03
12月
FDA批准Cobenfy用于成年人精神分裂症
精神分裂症(schizophrenia)是一种复杂的精神障碍,其症状多样且常常影响患者的日常生活。尽管现代药物治疗已取得显著进展,但该病依然没有一种药物能完全解决其广泛的症状和个体差异。近年来,精神分裂症的治疗方法并未出现革命性的突破。然而,近期美国食品药品监督管理局(FDA)批准了一种全新的药物——Cobenfy(由xanomeline和trospium chloride组成)。这一新药的批准不仅代表着治疗精神分裂症的新方向,也标志着几十年来药物治疗领域的一次重大突破。 Cobenfy:一种全新的药物类别 Cobenfy的批准为精神分裂症的治疗带来了新的希望。它属于一种新类别的药物,即mus... 查看详情
30
11月
Blarcamesine用于阿尔茨海默病治疗在欧盟提交上市申请
随着全球人口老龄化,阿尔茨海默病(Alzheimer’s Disease, AD)已成为当今最具挑战性的公共健康问题之一。根据欧洲脑委员会的数据,预计到2030年,欧洲患有阿尔茨海默病的人数将达到1400万。尽管目前已有多种治疗方法,但有效的药物仍然稀缺,现有疗法往往只能缓解症状,难以根治。为了应对这一挑战,Anavex Life Sciences公司近日向欧洲药品管理局(EMA)提交了其新型口服药物Blarcamesine的上市许可申请(MAA),该药物可能为阿尔茨海默病治疗带来新的希望。 Blarcamesine的临床优势与疗效 Blarcamesine(ANAVEX2-73)是一种口服小... 查看详情
29
11月
瑞波西利(Kisqali,Ribociclib)获欧盟批准用于HR+/HER2-早期乳腺癌的辅助治疗
乳腺癌是一种全球范围内高发的恶性肿瘤,即使患者在早期接受了标准治疗,复发风险仍然存在,尤其是在激素受体阳性、HER2阴性的患者中。近日,欧洲药品管理局批准了瑞波西利(Kisqali,Ribociclib)联合芳香化酶抑制剂(AI)用于这类高复发风险的早期乳腺癌患者的辅助治疗。这一突破性的治疗方案为许多患者带来了新的希望。 临床试验的坚实数据支撑 这项批准的依据是国际多中心III期NATALEE临床试验的结果。试验招募了超过5000名患者,主要目标是评估瑞波西利(Kisqali)联合AI与单用AI在减少侵袭性疾病复发或死亡风险方面的差异。 研究数据显示,在中位随访27.7个月时,瑞波西利(Kis... 查看详情
29
11月
欧盟批准替雷利珠单抗(Tevimbra)联合化疗用于晚期食管鳞状细胞癌及胃癌/胃食管交界腺癌的一线治疗
随着癌症治疗的不断发展,新的免疫治疗方法为许多患者带来了新的希望。特别是在一些晚期和转移性癌症的治疗中,免疫检查点抑制剂(如PD-1抑制剂)已逐渐成为重要的治疗选择。近年来,替雷利珠单抗(Tevimbra,tislelizumab)与化疗联合使用,成为治疗晚期食管鳞状细胞癌(ESCC)和胃癌/胃食管交界(GEJ)腺癌的前线治疗方案之一。2024年,欧洲委员会(EC)批准了替雷利珠单抗(Tevimbra)与化疗联合用于这些癌症的首次治疗。 替雷利珠单抗(Tevimbra)与化疗联合治疗的批准背景 食管癌和胃癌是全球范围内较为常见且致命的恶性肿瘤之一。根据全球癌症研究机构的数据,食管癌的死亡率长期... 查看详情
28
11月
FDA延长对DCCR(二氮嗪胆碱)缓释片在普拉德-威利综合征中的审评期限
罕见病往往难以诊断与治疗,而普拉德-威利综合征(Prader-Willi Syndrome,PWS)作为一种典型的遗传性疾病,给患者带来了巨大的生活困扰。近年来,随着医学研究的不断深入,针对PWS的治疗方案逐渐被提出,其中,DCCR(Diazoxide Choline,二氮嗪胆碱)缓释片作为一种新型药物,吸引了广泛关注。2024年11月26日,Soleno Therapeutics宣布,美国FDA延长了对DCCR缓释片的新药申请(NDA)审评期限,进一步为这种药物进入市场铺平道路。 DCCR缓释片:一款新型药物的诞生 DCCR(二氮嗪胆碱)缓释片是Soleno Therapeutics公司开发... 查看详情
28
11月
Rapiblyk(兰地洛尔)获FDA批准用于危重症环境下治疗房颤和房扑
在心血管疾病的紧急处理过程中,快速有效地控制心率是至关重要的,尤其是对于一些危及生命的心律失常,如房颤(atrial fibrillation,AF)和房扑(atrial flutter,AFL)。这些疾病可能突然发生,严重时会导致急性心血管问题,威胁患者生命。近年来,随着医学技术的进步,新型药物的研发为临床治疗提供了更多选择。2024年11月,AOP Orphan Pharmaceuticals GmbH宣布,其研发的药物Rapiblyk(landiolol,兰地洛尔)在美国获得了FDA批准,用于在医院急救环境下治疗房颤和房扑。这一批准不仅为美国的患者带来了新的治疗选择,也标志着该药物在全球... 查看详情
26
11月
脐带血干细胞疗法RegeneCyte获FDA批准
近年来,脐带血干细胞疗法逐渐成为治疗血液系统相关疾病的重要手段之一。近日,美国食品药品监督管理局(FDA)正式批准了RegeneCyte™的生物制品许可申请(BLA),为血液系统疾病患者带来了全新治疗方案。这一疗法旨在通过异基因脐带血来源的造血干细胞进行移植,帮助患者实现血液和免疫系统的重建。 疗法简介与作用机制 RegeneCyte是一种基于人类脐带血的异基因造血干细胞疗法,其核心成分为造血前体细胞(HPC)。这些细胞源自骨髓,通过分裂与成熟进入血液循环系统,发挥重建血液细胞功能的作用。通过与适当的准备方案结合使用,RegeneCyte可用于治疗多种遗传性、获得性或由化疗引发的血液系统疾病。... 查看详情
26
11月
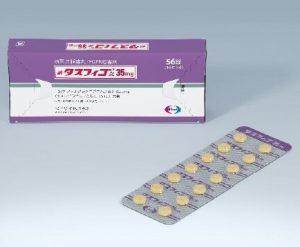
Tasfygo在日本上市用于FGFR2基因融合突变胆道癌治疗
胆道癌(BTC)是一种预后极差的恶性肿瘤类型,全球范围内治疗选择有限,尤其是针对特定基因突变的精准治疗手段更是稀缺。近日,日本药企卫材(Eisai)宣布,其新型药物Tasfygo(tasurgratinib succinate,琥珀酸他舒格替尼,原代号E7090)在日本正式上市。这一药物专为胆道癌患者开发,目标群体为肿瘤表达FGFR2基因融合突变的患者。 Tasfygo的作用机制及适用人群 Tasfygo是一种小分子成纤维细胞生长因子(FGF)受体抑制剂,其针对FGFR2基因融合或重排突变的患者设计。FGFR2基因突变与肿瘤的侵袭性密切相关,尤其在肝内胆管癌(胆道癌的一种亚型)中较为常见,占比... 查看详情
26
11月
MIPLYFFA(arimoclomol)在美国上市用于治疗C型尼曼匹克病
尼曼匹克病C型(Niemann-Pick disease type C, NPC)是一种罕见且进展性神经退行性疾病,严重影响患者的生活质量和寿命。这种疾病长期缺乏有效治疗方案,给患者及其家庭带来巨大压力。近日,Zevra Therapeutics宣布,MIPLYFFA™(arimoclomol)正式在美国上市。这是FDA批准的首个治疗NPC的药物,标志着治疗这一罕见疾病的重大进展。以下将从药物的上市、支持计划、作用机制、安全性信息及NPC疾病背景等多个方面展开详细阐述。 MIPLYFFA™正式上市:开创性治疗方案 MIPLYFFA™是FDA批准的首个专门用于治疗NPC的药物,适用于2岁及以上患... 查看详情