美纳里尼集团在2023 年 ESMO 乳腺癌大会和 2023 年 ASCO 年会上公布 Elacestrant 的新数据
意大利佛罗伦萨和纽约–(美国商业资讯)–意大利领先的制药和诊断公司美纳里尼集团(“美纳里尼”)和美纳里尼集团的全资子公司Stemline Therapeutics(“Stemline”),今天宣布,他们将在即将召开的大会上展示与 elacestrant 相关的新数据。
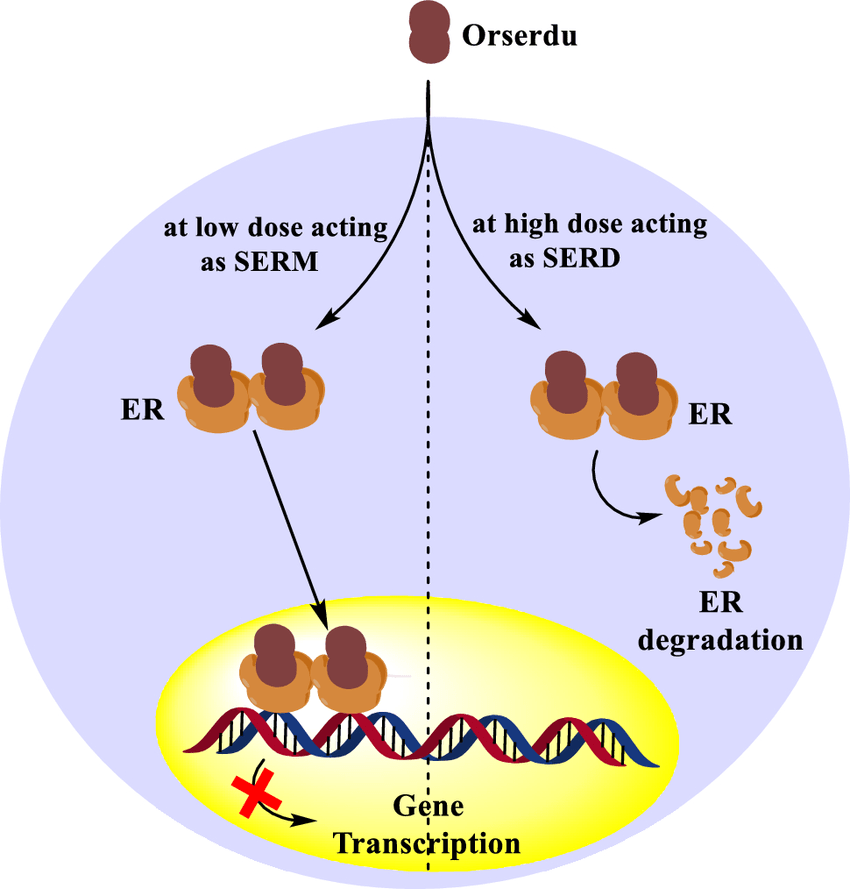
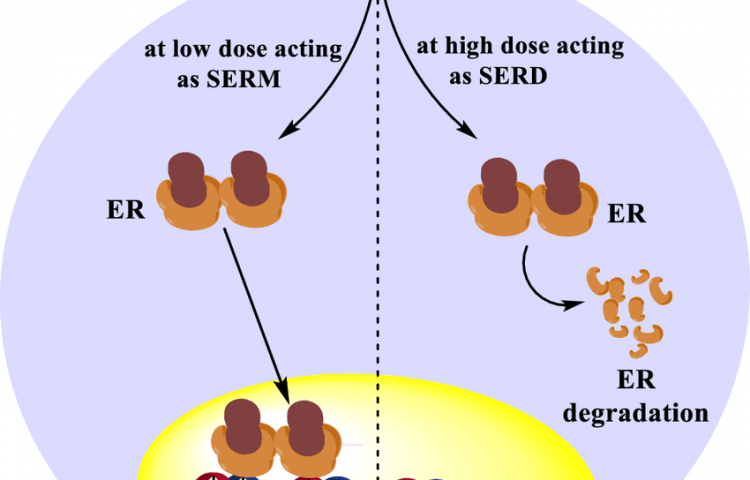
Elacestrant 已被 FDA 批准用于治疗患有雌激素受体(ER)阳性、人表皮生长因子受体 2(HER2)阴性、ESR1 突变的晚期或转移性乳腺癌的绝经后妇女或成年男性,并且至少在以下情况下疾病进展一线内分泌治疗。新数据将在即将召开的 2023 年欧洲肿瘤内科学会 (ESMO) 乳腺癌大会和 2023 年美国临床肿瘤学会 (ASCO) 年会上公布。
“ ER+/HER2- 乳腺癌占所有乳腺癌的 70%。ORSERDU® (elacestrant)是FDA 20 年来批准的首个新内分泌疗法,用于治疗 ER+、HER2-、ESR1 突变的转移性乳腺癌 (mBC),该亚组出现在高达 40% 的二线 mBC 和美纳里尼集团首席执行官 Elcin Barker Ergun 表示:“我们继续为不同亚组的 elacestrant 生成新数据以及生活质量数据,这很重要,因为在治疗期间能够过上正常的生活是乳腺癌患者的重要目标。”
2023 年 ESMO 乳腺癌大会
摘要标题:EMERALD 试验分析 ER+/HER2− 晚期或转移性乳腺癌 (mBC) 患者的患者报告结果 (PRO),比较口服 elacestrant 与标准护理 (SoC) 内分泌治疗 摘要编号:
1880
会议标题:提交论文会议 1 (ID 7)
会议日期和时间:2023 年 5 月 11 日;2:00-3:30 PM CEST,汉堡厅
演讲类型:口头(提供论文)
2023 ASCO 年会
摘要标题:口服 elacestrant 与标准护理治疗雌激素受体阳性、HER2 阴性 (ER+/HER2-) 晚期或转移性乳腺癌 (mBC),无可检测到的 ESR1 突变 (EMERALD):先前的亚组分析CDK4/6i 加内分泌治疗 (ET) 的持续时间
摘要#: 1070 | 海报 Bd 编号:291
会议标题:乳腺癌 – 转移性
会议日期和时间:2023 年 6 月 4 日;上午 8:00 CDT,A 厅
演示类型:海报
关于 EMERALD 3 期研究 (NCT03778931)
EMERALD 3 期试验是一项随机、开放标签、主动对照研究,评估 elacestrant 作为 ER+、HER2- 晚期/转移性乳腺癌患者的二线或三线单一疗法。该研究纳入了 478 名患者,他们之前接受过一种或两种内分泌治疗,包括 CDK4/6 抑制剂。研究中的患者被随机分配接受 elacestrant 或研究者选择的经批准的激素药物。该研究的主要终点是总体患者群体和雌激素受体 1 基因 (ESR1) 突变患者的无进展生存期 (PFS)。
关于 ORSERDU ® (elacelestrant)
适应症
ORSERDU(elacestrant),345毫克片剂,经美国食品和药物管理局(FDA)批准用于治疗雌激素受体(ER)阳性、人表皮生长因子受体2(HER2)的绝经后妇女或成年男性阴性、ESR1 突变的晚期或转移性乳腺癌,在至少一种内分泌治疗后疾病进展。
营销授权申请 (MAA) 目前正在接受欧洲药品管理局 (EMA) 的审查。
Elacestrant 还在转移性乳腺癌疾病的多项临床试验中进行研究,单独使用或与其他疗法联合使用:ELEVATE ( NCT05563220 );伊莱克特拉(NCT05386108);和 ELCIN ( NCT05596409 )。Elacestrant 还计划在早期乳腺癌疾病中进行评估。
重要安全信息,ORSERDU ®
警告和注意事项
血脂异常:服用 ORSERDU 的患者发生高胆固醇血症和高甘油三酯血症的发生率分别为 30% 和 27%。3级和4级高胆固醇血症和高甘油三酯血症的发生率分别为0.9%和2.2%。在开始服用 ORSERDU 之前和期间定期监测血脂状况。
胚胎-胎儿毒性
根据动物研究结果及其作用机制,ORSERDU 给孕妇服用可能会对胎儿造成伤害。告知孕妇和具有生殖潜力的女性对胎儿的潜在风险。建议有生殖潜力的女性用 ORSERDU 治疗期间和末次剂量后 1 周内使用有效避孕。忠告有生育潜力女性伴侣的男性患者在用 ORSERDU 治疗期间和末次剂量后 1 周内使用有效避孕。
不良反应
接受 ORSERDU 治疗的患者中有 12% 发生严重不良反应。接受 ORSERDU 治疗的患者中>1%的严重不良反应是肌肉骨骼疼痛(1.7%)和恶心(1.3%)。接受 ORSERDU 治疗的患者中有 1.7% 发生致命不良反应,包括心脏骤停、感染性休克、憩室炎和原因不明(各一名患者)。
ORSERDU最常见的不良反应(≥10%),包括实验室异常是肌肉骨骼疼痛(41%)、恶心(35%)、胆固醇升高(30%)、AST升高(29%)、甘油三酯升高(27%) )、疲劳(26%)、血红蛋白降低(26%)、呕吐(19%)、ALT升高(17%)、钠降低(16%)、肌酐升高(16%)、食欲下降(15%)、腹泻(13%)、头痛(12%)、便秘(12%)、腹痛(11%)、潮热(11%)和消化不良(10%)。
药物相互作用
与CYP3A4诱导剂和/或抑制剂同时使用:避免强或中度CYP3A4抑制剂与ORSERDU同时使用。避免强或中度 CYP3A4 诱导剂与 ORSERDU 同时使用。
在特定人群中的使用
哺乳期:建议哺乳期妇女在 ORSERDU 治疗期间和最后一次给药后 1 周内不要母乳喂养。
肝受损:严重肝受损患者(Child-Pugh C)避免使用 ORSERDU。在有中度肝受损患者(Child-Pugh B)中减少ORSERDU的剂量。
ORSERDU 在儿科患者中的安全性和有效性尚未确定。
如需报告疑似不良反应,请致电 1-877-332-7961 联系 Stemline Therapeutics, Inc.,或发送电子邮件至StemlinePVG.SM@ppd.com,或致电 1-800-FDA-1088 或访问www.fda.gov/medwatch联系 FDA 。
关于美纳里尼集团
美纳里尼集团是一家领先的国际制药和诊断公司,营业额超过 40 亿美元,拥有超过 17,000 名员工。美纳里尼专注于需求未得到满足的治疗领域,提供心脏病学、肿瘤学、呼吸病学、胃肠病学、传染病、糖尿病学、炎症和镇痛产品。美纳里尼拥有 18 个生产基地和 9 个研发中心,其产品销往全球 140 个国家。欲了解更多信息,请访问www.menarini.com。
关于 Stemline Therapeutics
Stemline Therapeutics 是美纳里尼集团的全资子公司,是一家商业阶段的生物制药公司,专注于新型肿瘤治疗药物的开发和商业化。美纳里尼集团于 2020 年 7 月从 Radius Health, Inc. 获得了 elacestrant 的全球许可权。美纳里尼集团现在全面负责 elacestrant 的全球注册、商业化和进一步开发活动。Stemline 将 ORSERDU ®商业化在美国,Elacestrant 是一种口服小分子内分泌疗法,适用于治疗雌激素受体 (ER) 阳性、人表皮生长因子受体 2 (HER2) 阴性、ESR1 突变的晚期或晚期绝经后女性或成年男性。至少一种内分泌治疗后疾病进展的转移性乳腺癌。Stemline 还在美国和欧洲将 ELZONRIS ® (tagraxofusp-erzs) 商业化,这是一种针对 CD123 的新型靶向治疗药物,用于治疗母细胞性浆细胞样树突状细胞肿瘤 (BPDCN)(一种侵袭性血液癌症)患者,这是唯一获批的 BPDCN治疗方法迄今为止在美国和欧盟。Stemline 还将 Nexpovio ®商业化在欧洲,一种用于治疗多发性骨髓瘤的 XPO1 抑制剂。Stemline 还拥有广泛的小分子和生物制剂临床产品线,这些产品处于不同的开发阶段,用于治疗多种实体癌和血液癌。

注:以上资讯来源于网络,并由致泰药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助全球各地华人患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药建议及依据, 如想要进一步了解药品,请谘询主治医师。