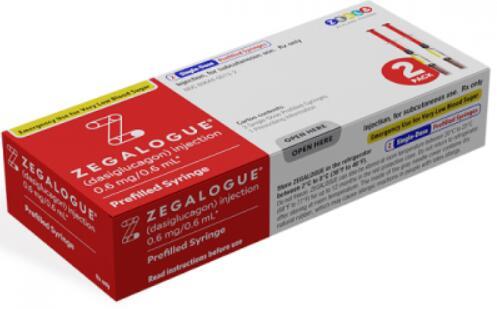
Zegalogue(Dasiglucagon)获FDA优先审查,助力解决先天性高胰岛素血症治疗难题
随着医学科技的不断发展,先天性高胰岛素血症的治疗领域迎来了新的希望。新西兰制药公司近日宣布,其新药Dasiglucagon(中文名:达西格列酮)已获得美国食品药品监督管理局(FDA)的优先审查批准。这一新药具有胰高血糖素受体激动剂的特性,旨在预防和治疗7天及以上患有先天性高胰岛素血症(CHI)的儿童患者低血糖症。
目录
CHI的严峻挑战及治疗需求
先天性高胰岛素血症是一种罕见的遗传疾病,主要影响婴儿和儿童。该疾病导致胰腺β细胞功能异常,过度分泌胰岛素,从而引发频繁、复发性和严重的低血糖发作。持续的低血糖发作可能引发癫痫、脑损伤甚至死亡。
Dasiglucagon的治疗机制及重要性
目前,针对CHI引发的低血糖,药物治疗和外科手术是主要的治疗手段。然而,现有药物存在一定的局限性,如二氮嗪使用可能带来不良反应风险。而Dasiglucagon则通过促使肝脏释放储存的糖分到血液中发挥作用,有望成为新的治疗选择。
药物研发进程与先前成就
Dasiglucagon作为一种胰高血糖素类似物,已在2021年以Zegalogue的商品名在美国上市,用于治疗糖尿病成人和儿童的严重低血糖。此外,该药正在寻求在CHI治疗中的应用。
临床试验及结果
新西兰制药公司在试验1(NCT04172441)和试验2(NCT03777176)中评估了Dasiglucagon的疗效和安全性。试验1表明,Dasiglucagon通过皮下注射在儿童中减少了静脉注射葡萄糖的需求,试验2则显示,Dasiglucagon能够减少低血糖事件发作的时间和数量。
总体而言,Dasiglucagon的优先审查批准为先天性高胰岛素血症患者带来了新的治疗选择,具有重要的临床意义。随着药物研发的不断深入和临床实践的积累,Dasiglucagon有望在未来为CHI患者提供更为有效的治疗方式,帮助他们摆脱低血糖的困扰。

注:以上资讯来源于网络,并由致泰药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助全球各地华人患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药建议及依据, 如想要进一步了解药品,请谘询主治医师。